Étude CHRONO
Fiche descriptive de l'étude
Étude ovaire
CHRONO
Titre de l'étude
CHRONO : Chirurgie retardée après une chimiothérapie néoadjuvante dans le cancer de l’ovaire avancé (CHRONO). GINECO-CHIR101
Statut
En cours de suivi
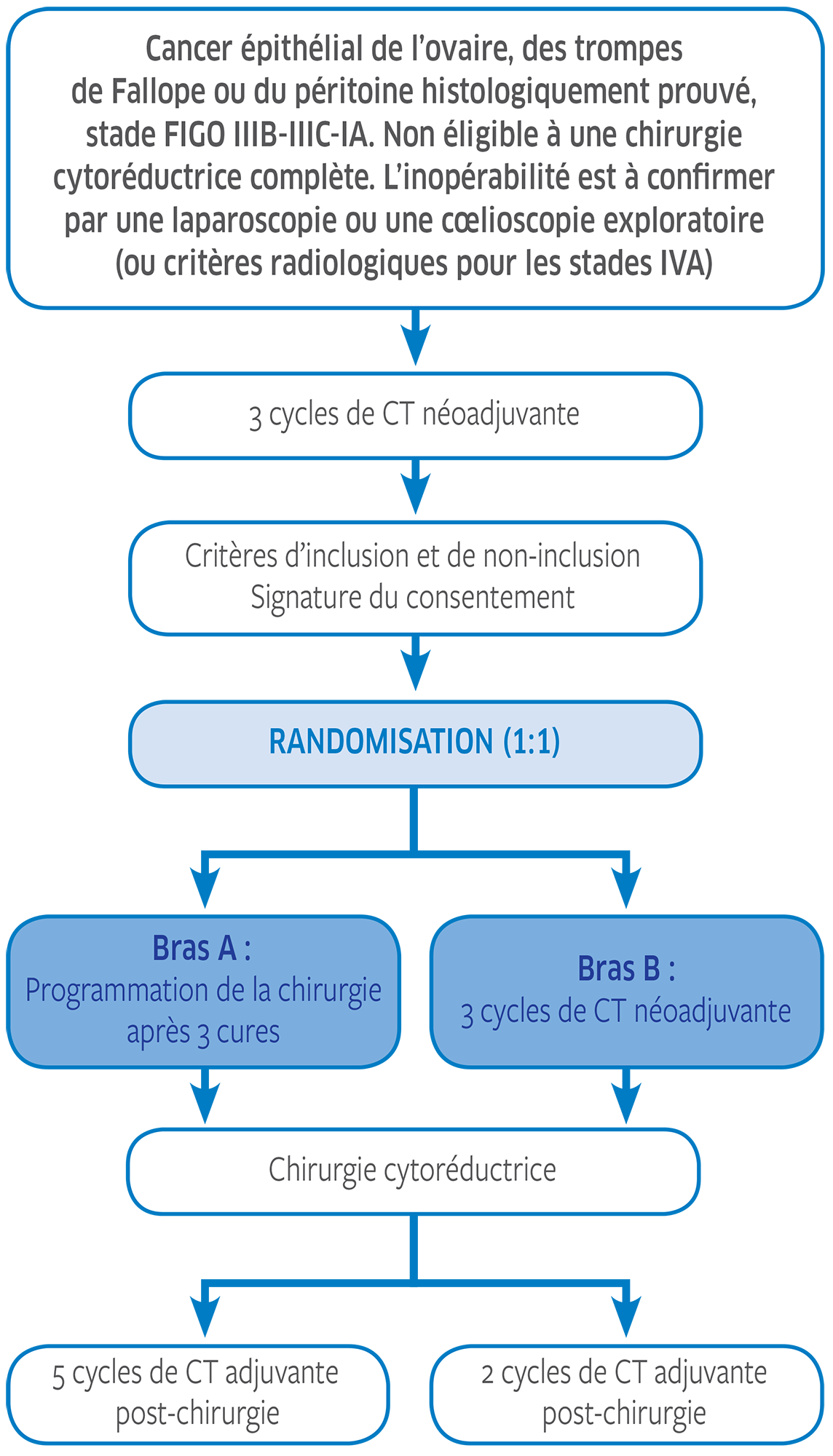
Plan de traitement de l'étude
Promoteur
ARCAGY - GINECO
But
Rationnel : Évaluer la meilleure stratégie pour la prise en charge des cancers avancés de l’ovaire, en évaluant le moment le plus adapté pour la réalisation de la chirurgie d’intervalle : soit après 3 cycles de chimiothérapie néoadjuvante, soit après 6 cycles.
Objectif primaire :
La survie sans maladie
Objectifs secondaires :
- La qualité de vie ciblée sur les 3 dimensions suivantes (physique, abdominale/ gastro-intestinal, fatigue)
- Le taux de PCR (réponse pathologique complète)
- Survie globale (OS)
- Autres dimensions de la qualité de vie liée à la santé (HRQOL)
- Evaluation du délai entre la fin de traitement et le nouveau traitement (TFST)
- Mortalité post-opératoire
- Morbidité post-opératoire (selon la classification Clavien Dindo)
- Évaluation du score FAGOTTI
- Tolérance de la chimiothérapie néoadjuvante, de la chirurgie d’intervalle et de la chimiothérapie adjuvante.
Objectifs ancillaires :
- Évaluation du score PCI
- Évaluation du score d’une chirurgie cytoréductrice complète par rapport aux biopsies péritonéales systématiques
- Évaluation du CA125 durant la chimiothérapie néoadjuvante
- Évaluation de la vulnérabilité
- Évaluation de la chirurgie réalisée par laparoscopie
Critères principaux d'évaluation
Évaluer la meilleure stratégie pour la prise en charge des cancers avancés de l’ovaire, en évaluant le moment le plus adapté pour la réalisation de la chirurgie d’intervalle : soit après 3 cycles de chimiothérapie néoadjuvante, soit après 6 cycles. La survie sans maladie est définie comme le délai entre la randomisation et la rechute ou le décès.
Phase
Phase II
Type de patiente
Une patiente sera éligible à l’inclusion dans l’étude si elle répond à tous les critères suivants :
- Age ≥ 18 ans
- Cancer épithélial ovarien histologiquement prouvé ou carcinome des trompes de Fallope ou cancer du péritoine à l’exception des carcinomes mucineux, à cellules claires ou des carcinosarcomes.
- Performance status ≤ 2
- International Federation of Gynecologic Oncology (FIGO) stage IIIB-IIIC-IV, non éligible à une chirurgie cytoréductrice complète. (confirmer par une laparoscopie ou une laparotomie).
- Patiente jugée résécable après 3 cycles de chimiothérapie néoadjuvante.
- Fonction hépatiques, rénales, hémato compatibles avec l’indication de chimiothérapie et de chirurgie :
- GB > 3x109/L, PNN ≥ 1,5x109/L, Plaquettes ≥ 100x109/L, Hb ≥ 9g/dL
- Créatinine plasmatique < 1,25xLSN ou clairance de la créatinine ≥ 30 mL/min (selon Cockroft-Gault ou normes du laboratoire), bilirubine < 1,25xLSN, ASAT (SGOT) et ALAT (SGPT) < 2,5xLSN.
- Signature du consentement avant toutes procédures spécifiques de l’essai
- Patiente affiliée à un régime de sécurité sociale
Nombre de patientes recrutées
211 patientes dans environ 27 centres France