Étude ANITA
Fiche descriptive de l'étude
Étude ovaire
ANITA
Titre de l'étude
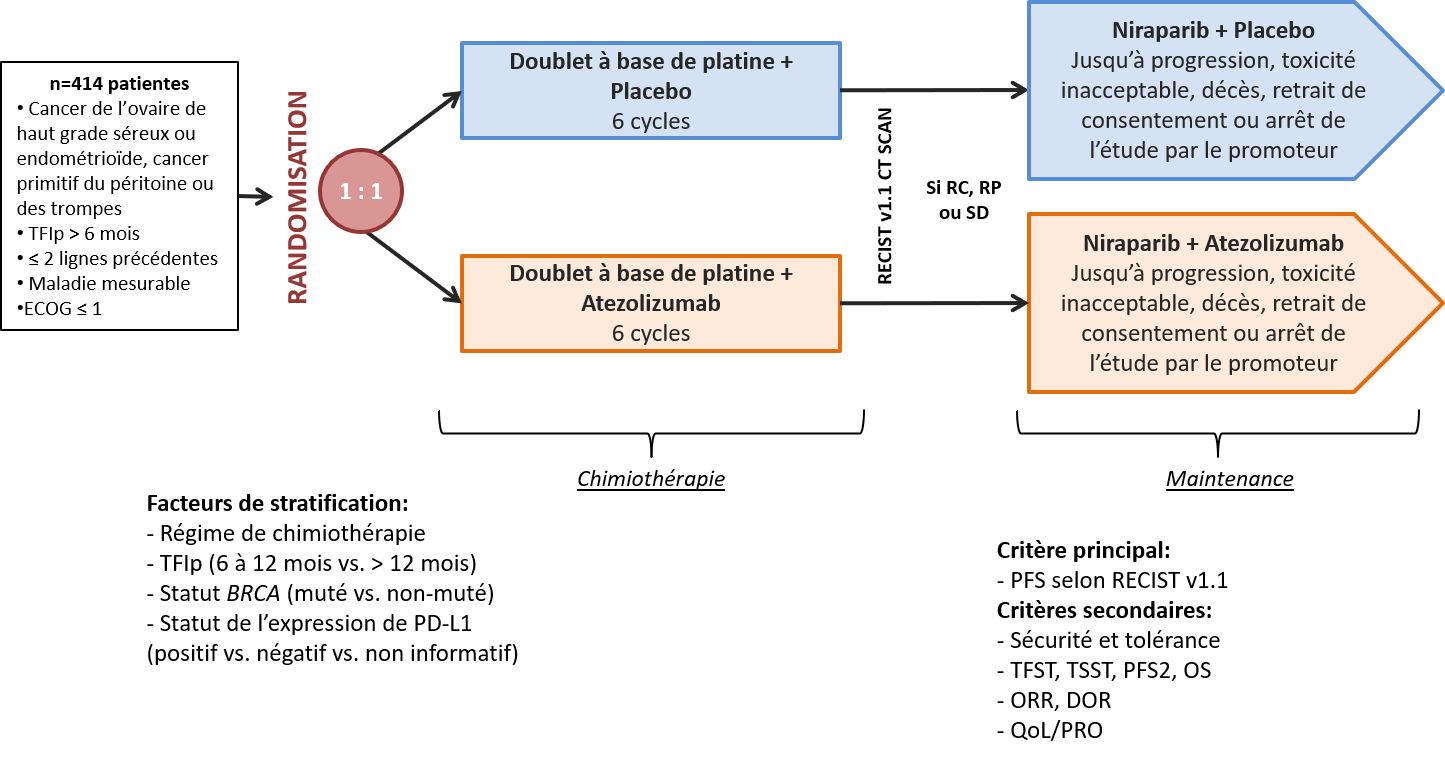
ANITA : A phase III, randomized, double-blinded trial of platinum-based chemotherapy followed by niraparib maintenance with or without atezolizumab in patients with recurrent ovarian, tubal or peritioneal cancer and platinum treatment-free interval (TFIp)> 6M.
Statut
Recrutement terminé / suivi
Plan de traitement de l'étude
Promoteur
GEICO
But
OBJECTIF PRINCIPAL
Déterminer si l’ajout de l’atezolizumab à la chimiothérapie à base de platine suivie d’une maintenance avec le niraparib améliore la survie sans progression (PFS) comparé au placebo chez des patientes atteintes d’un cancer de l’ovaire, des trompes ou du péritoine sensibles au platine (i.e. ayant un intervalle libre sans traitement à base de platine (TFIp) d’une durée d’au moins 6 mois)
OBJECTIFS SECONDAIRES
- La survie globale (OS)
- Le délai entre la randomisation et le début du traitement à la rechute ou le décès (TSST)
- Le délai entre la randomisation et le début d’un traitement à la seconde rechute ou le décès (TSST)
- Le délai entre la randomisation et la seconde rechute (PFS2)
- La sécurité et la tolérance de l’ajout de l’atezolizumab comparé au placebo
- L’effet du traitement par l’atezolizumab versus le placebo sur les symptômes abdominaux du cancer de l’ovaire rapportés par les patientes. Il sera mesuré à l’aide de 2 items de l’échelle EORTC QLQ-OV28 évaluant les symptômes abdominaux/gastro-intestinaux
- Les résultats rapportés par les patientes (Patient-reported Outcome, PRO) associés avec le traitement par l’atezolizumab versus le placebo pour la fonction et la qualité de vie liée à la santé (Health Related Quality of Life, HRQoL), mesuré par l’échelle EORTC QLQ-C30
- Le taux de réponse objectif (ORR) selon RECIST v1.1 pendant la phase de chimiothérapie et pendant la phase de maintenance
- La durée de réponse (DOR)
- La survie sans progression (PFS) depuis le début de la phase de maintenance chez toutes les patientes, chez les patientes avec une réponse complète ou partielle après la fin de chimiothérapie et chez les patientes avec une maladie stable après la fin de la chimiothérapie
- L’efficacité de l’atezolizumab versus le placebo selon le statut BRCA
- Caractériser le PK de l’atezolizumab et déterminer l’incidence des anticorps anti-médicaments (Anti-Therapeutic Antibodies, ATA) pour évaluer la réponse immunitaire à l’atezolizumab
- Evaluer l’efficacité de l’atezolizumab versus placebo dans les sous-groupes PD-L1 positif et PD-L1 négatif.
Phase
Phase III
Type de patiente
Patientes atteintes d’un cancer de l’ovaire, des trompes ou du péritoine en rechute tardive ayant reçu 1 ou 2 lignes de chimiothérapie. La dernière ligne de chimiothérapie doit contenir du platine.
Nombre de patientes recrutées
417 patientes dans environ 73 centres
121 patientes en France dans 17 centres
Critère principal d’évaluation
La survie sans progression (PFS) de la randomisation jusqu’à la progression évaluée par l’investigateur selon les critères RECIST v1.1.
- Moyenne et changement moyen par rapport au score à la baseline des symptômes liés à la maladie et/ou au traitement et entre les bras de traitement, évalué par l’ensemble des items et/ou des échelles EORTC QLQ-C30 et QLC-OV28
- Proportion de patientes rapportant chacune des options de réponse à chaque évaluation selon le bras de traitement pour l’item GP5 du FACT-G
- Scores d’utilité pour la santé de l’EQ-5D-5L et l’EQ-VAS
- Relation entre les biomarqueurs tumoraux liés à l’immunité ou liés au type de pathologie (incluant, mais non limités à la charge mutationnelle, PD-L1, TILs et CD8) dans les tissus tumoraux ou les échantillons de sang, et les critères cliniques
- Relation entre certains biomarqueurs exploratoires (ex : ADN circulant, protéines et cytokines) évaluée à partir du plasma avant, pendant et après traitement, et les critères cliniques
- Relation entre les ATB utilisés pendant 2 mois avant et 1 mois après la première administration de l’atezolizumab pendant l’étude et l’efficacité mesurée par la PFS et l’OS
- Relation entre l’utilisation antérieure d’inhibiteurs de PARP en première ligne et les critères d’évaluation cliniques
- Relation entre l’émergence d’ATA et les critères d’évaluation de l’efficacité, la sécurité ou la PK.