Étude ATALANTE - Cancer Ovaire
Fiche descriptive de l'étude
Étude ovaire
ATALANTE (ATezolizumab and Avastin in LAte recurreNT diseasE)
Titre de l'étude
ATALANTE : Etude de phase III, randomisée, en double aveugle, comparant atezolizumab versus placebo chez des patientes atteintes d’un cancer épithélial de l’ovaire, des trompes ou du péritoine, en rechute tardive et traitées par l’association d’une chimiothérapie à base de platine et de bevacizumab.
Statut de l'étude
Recrutement terminé / Suivi en cours
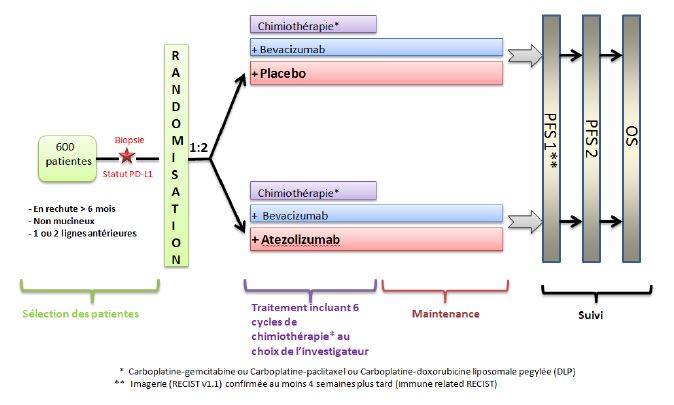
Schéma de l'étude
Promoteur
ARCAGY-GINECO: (Association de Recherche contre les CAncers dont GYnécologiques)
But
Objectif principal
Déterminer l’efficacité, en termes de survie sans progression (SSP) évaluée par l’investigateur selon les critères RECIST version 1.1, de l’ajout de l’atezolizumab comparée au placebo dans le traitement des patientes atteintes d’un adénocarcinome de l’ovaire, des trompes ou du péritoine, en rechute tardive et recevant une chimiothérapie standard et du bevacizumab.
Les co-critères de jugement principaux sont la survie sans progression (SSP) dans la population ITT et dans la sous-population PDL1+ (expression PDL1 ≥ 1%).
Objectif secondaire
Survie globale, Délai entre la randomisation et l’initiation d’un traitement à la deuxième rechute (TSST) ou décès, Qualité de vie, Survie à long terme, SSP et survie globale dans la sous-population PDL1+/CD8+, Taux de réponses objectives, SSP selon irRECIST, caractérisation du marqueur tumoral CA125 en fonction de la SSP selon RECIST v1.1 et irRECIST, PFS2, Tolérance.
Phase
Phase III
Type de patiente
Patientes atteintes d’un cancer épithélial de l’ovaire, des trompes ou du péritoine, en rechute tardive et traitées par l’association d’une chimiothérapie à base de platine et de bevacizumab.
Nombre de patientes recrutées
614 patientes dans 74 centres
441 patientes en France dans 39 centres
Critère principal d’évaluation
Survie sans progression (SSP) évaluée par l’investigateur selon les critères RECIST version 1.1. Il s’agit de co-critères de jugement principaux qui sont la survie sans progression (SSP) dans la population ITT et dans la sous-population des patientes PDL1+ (expression PDL1 ≥ 1%).