Étude OREO
Fiche descriptive de l'étude
Étude ovaire
OREO
Titre de l'étude
OREO : Etude de Phase IIIb, multicentrique, randomisée, en double aveugle contre placebo, de l'Olaparib en traitement d'entretien chez des patientes atteintes de cancer épithélial de l'ovaire précédemment traité par iPARP et répondant à une nouvelle chimiothérapie à base de platine (OReO)
Statut
Clôture en cours
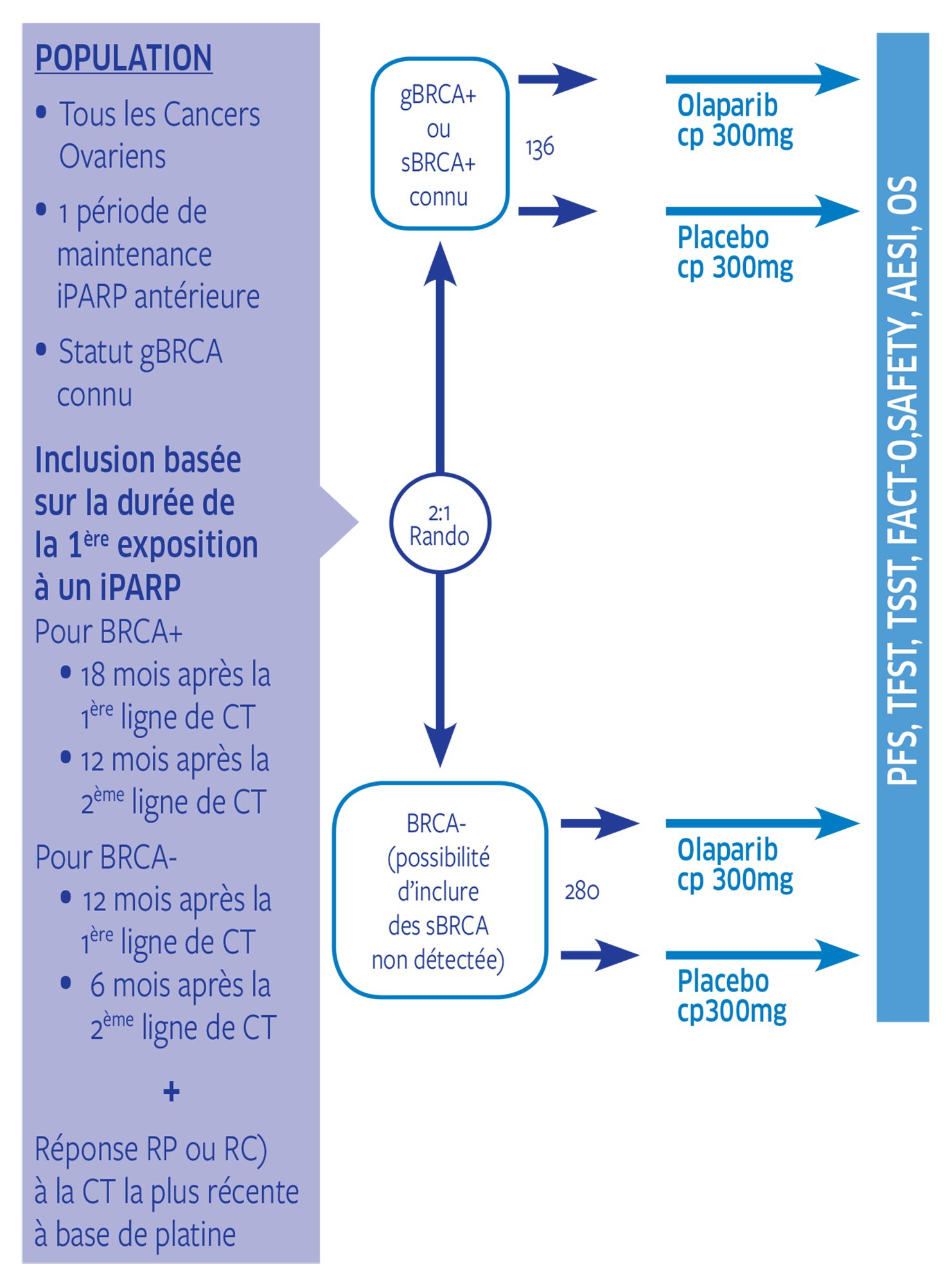
Plan de traitement de l'étude
Promoteur
Nom du promoteur : Astra Zeneca en collaboration avec le réseau ENGOT
Groupe Leader : ARCAGY-GINECO
But
Etude de Phase IIIb, multicentrique, randomisée, en double aveugle contre placebo, pour évaluer l'efficacité et la tolérance d'un retraitement par olaparib, versus placebo, chez des patientes atteintes de cancer épithélial de l'ovaire (CEO) non mucineux (y compris des patientes atteintes de cancer primitif du péritoine et/ou des trompes de Fallope). Pour être éligibles, les patientes doivent avoir reçu un traitement d'entretien par un inhibiteur de polymérisation du polyadénosine 5’diphosphoribose [poly(ADP ribose)] (iPARP; ou un traitement en aveugle dans un essai avec un iPARP comme groupe expérimental) pendant une période définie (voir Population visée) et doivent avoir présenté au moins une réponse partielle à leur cycle le plus récent de chimiothérapie à base de platine (carboplatine ou cisplatine). Les patientes seront recrutées en fonction de leur statut BRCA (gène de susceptibilité au cancer.
Phase
Phase 3b
Type de patiente
La population visée est celle des patientes atteintes de CEO non mucineux (y compris les patientes atteintes de cancer primitif du péritoine et/ou des trompes de Fallope) présentant une rechute de leur maladie qui reste sensible à une chimiothérapie à base de platine (celles qui ont obtenu une réponse radiologique – partielle ou complète – à leur plus récente chimiothérapie à base de platine) et qui ont déjà reçu une cure de traitement d'entretien par iPARP, seul ou en association avec d'autres composés (comme les inhibiteurs du récepteur du facteur de croissance endothélial vasculaire [iVEGFR]).
Toutes les patientes doivent avoir un statut génétique confirmé pour BRCA1 et BRCA2.
Nombre de patientes recrutées
220 patientes ont été randomisées dont 58 en France.
Critère principal d’évaluation
Objectif principal
Déterminer l'efficacité du retraitement d'entretien par olaparib versus placebo en évaluant la survie sans progression de la maladie (SSP)
Critère d'évaluation
Temps écoulé entre la randomisation et la progression de la maladie évaluée par l'investigateur (selon les critères RECIST version 1.1) ou le décès (de quelque cause que ce soit, en l'absence de progression)







