Étude ROCSAN
Fiche descriptive de l'étude
Étude ovaire
ROCSAN
Titre de l'étude
ROCSAN : Etude de phase II/III, randomisée, multicentrique évaluant le TSR-042 (anti-PD-1 mAb) associé au Niraparib versus le Niraparib seul comparé à la chimiothérapie chez des patientes atteintes d’un carcinosarcome métastasique ou en récidive de l’ovaire ou de l’endomètre après une chimiothérapie de première intention.
Statut
Recrutement terminé / suivi
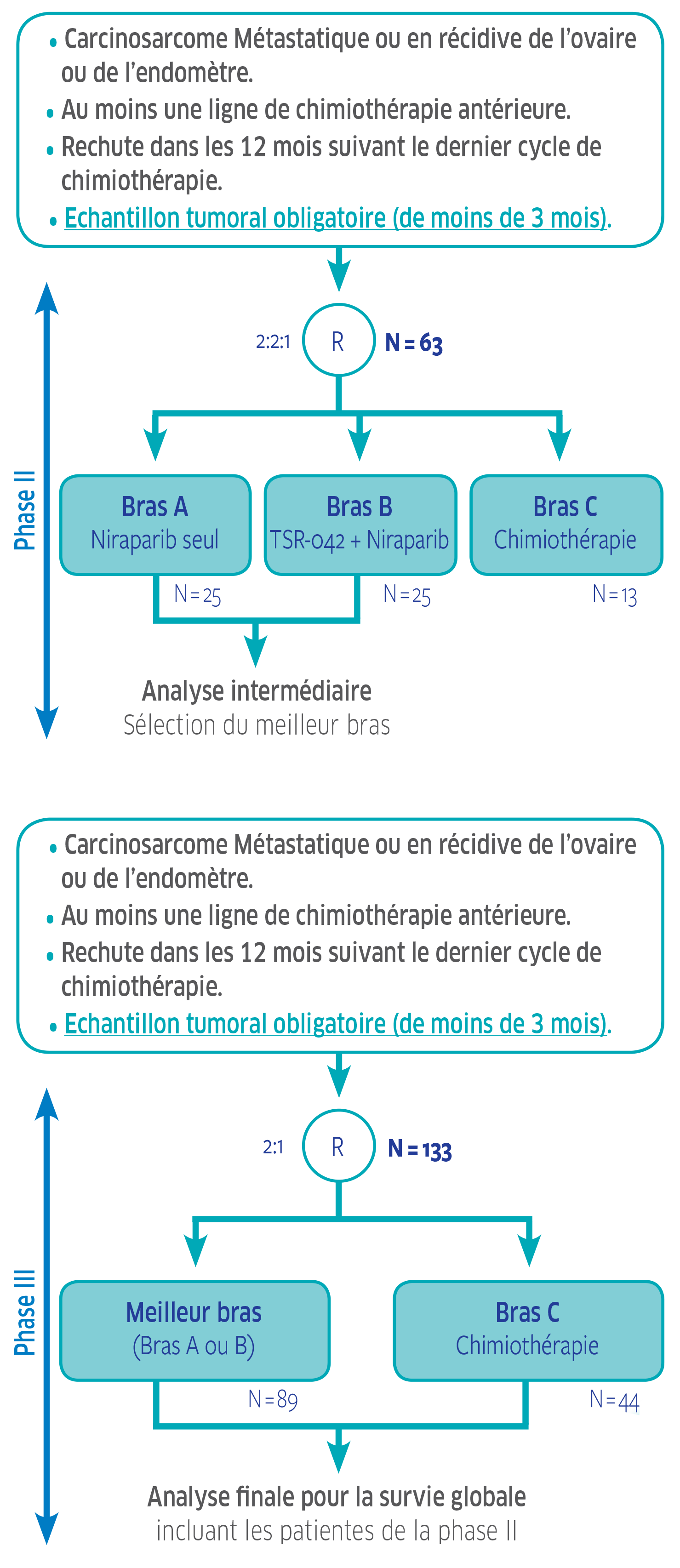
Plan de traitement de l'étude
Promoteur
ARCAGY - GINECO
But
Objectifs principaux :
-
Phase II – phase de sélection : Sélectionner la meilleure stratégie thérapeutique entre l’association niraparib et TSR-042 (Dostarlimab), et le niraparib en monothérapie.
-
Phase III : Comparer la survie globale chez les patientes ayant un carcinosarcome en progression ou récidivant de l’endomètre, de l’ovaire ou des trompes de Fallope, et ayant reçu au moins un traitement à base de platine, entre la meilleure stratégie expérimentale et la chimiothérapie seule.
Objectifs secondaires :
-
Approfondir l’évaluation du profil de sécurité global du meilleur bras expérimental comparé à la chimiothérapie seule
-
Comparer l’activité anti-tumorale entre la meilleure stratégie expérimentale et la chimiothérapie seule standard
-
Comparer le bénéfice clinique entre la meilleure stratégie expérimentale et la chimiothérapie seule
-
Comparer la Survie Sans Progression (PFS2 – délai entre la randomisation et la seconde progression) entre la meilleure stratégie expérimentale et la chimiothérapie seule
-
Comparer les effets des traitements sur les symptômes rapportés par les patients et la Qualité de vie.
Phase
Phase II / III
Type de patiente
Patientes atteintes d’un carcinosarcome métastasique ou en récidive de l’ovaire ou de l’endomètre après une chimiothérapie de première intention à base de platine.
Nombre de patientes à recruter
196 patientes dans environ 80 centres
120 patientes en France dans environ 20 centres
Critères principaux d'évaluation
- Phase II : Le critère principal est le taux de réponse à 4 mois, défini comme la proportion de patientes avec une réponse partielle (PR) ou une réponse complète (CR) 4 mois après la randomisation.
- Phase III : Le critère principal est la survie globale (OS), définie comme le temps entre la date de la randomisation et le décès, quelle qu'en soit la cause. Toute patiente dont le décès n’est pas confirmé au moment de l'analyse sera censurée sur la base de la dernière date enregistrée à laquelle la patiente était vivante.







