Étude EUDARIO
Fiche descriptive de l'étude
Étude ovaire
EUDARIO
Titre de l'étude
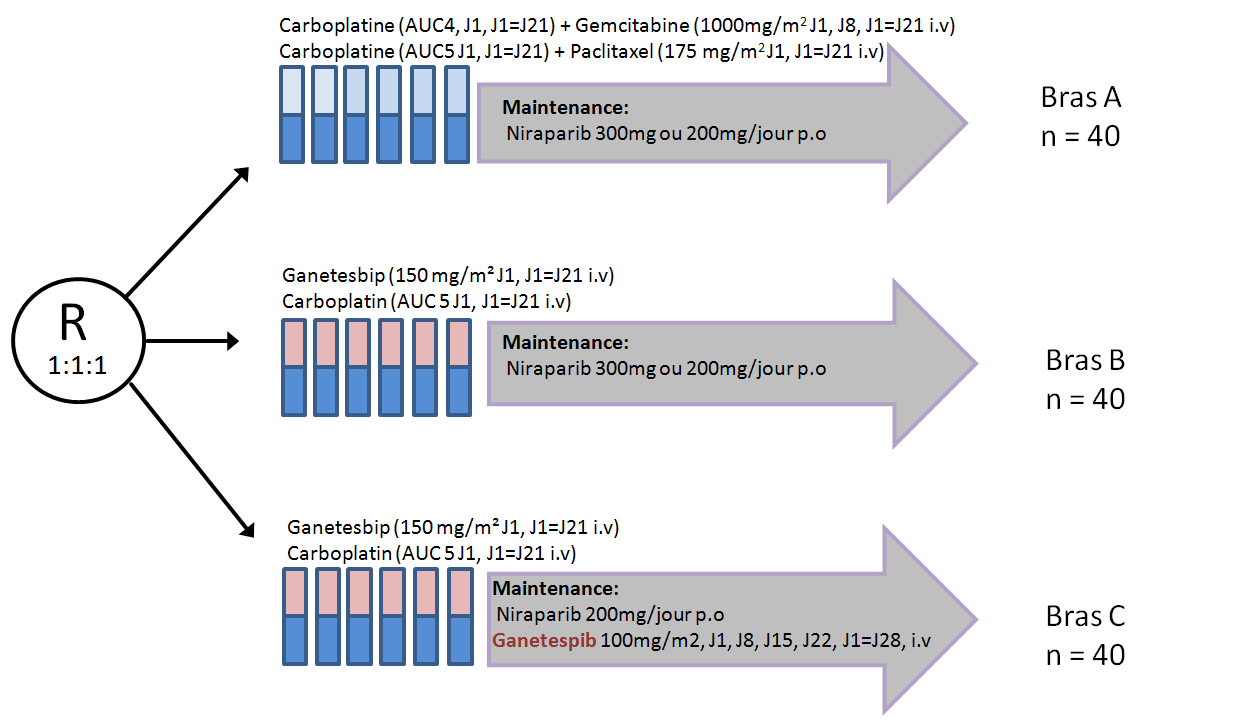
EUDARIO : Etude de phase II, multicentrique et randomisée évaluant la tolérance et l’efficacité du Ganetespib en combinaison avec le Carboplatine suivi par un traitement de maintenance par Niraparib versus Ganetespib et Carboplatine suivi par Ganetespib et Niraparib versus Carboplatine en combinaison avec la chimiothérapie standard suivi par Niraparib chez des patientes atteintes d’un cancer de l’ovaire platine-sensible.
Statut
Recrutement terminé. Suivi en cours
Plan de traitement de l'étude
Promoteur
Catholic University of Leuven, UZLeuven – BGOG
Rationnel
Évaluation de la tolérance et de l’efficacité du Ganetespib en combinaison avec le Carboplatine et en traitement de maintenance en combinaison avec le Niraparib suivi par un traitement de maintenance par Niraparib.
But
OBJECTIF PRINCIPAL :
Survie sans progression (PFS) selon RECIST 1.1
OBJECTIFS SECONDAIRES :
- PFS dans les sous-groupes définis
- Survie avant seconde progression (PFS2)
- Durée avant l’instauration du premier traitement suivant (TFST)
- Durée avant l’instauration du second traitement suivant (TSST)
- Tolérance : évènements indésirables (EIs) selon NCI CTCAE version 5.0
- Taux de réponse objective (ORR)
- Qualité de vie (autoquestionnaires)
- Survie globale (OS)
Phase
Phase II
Type de patiente
Patientes atteintes d’un cancer épithélial de l’ovaire en rechute, des trompes de Fallope ou péritonéal primitif, carcinosarcome, séreux de haut grade, endométrioïde de haut grade ou indifférencié (diagnostic histologique) et sensible aux sels de platine.
Nombre de patientes recrutées
International : 120 patientes dans 13 centres (5 pays)
France : 17 patientes dans 2 centres
Bilans
Screening et Baseline
- Examen clinique, biologique
- ECG, échographie cardiaque
- Scanner ou IRM
- Questionnaires de qualité de vie EORTC-QLQ-C30, EORTC-QLQ-OV28
- Biopsie optionnelle
Période de traitement
- Examen clinique, biologique
- Scanner ou IRM
- Questionnaires de qualité de vie EORTC-QLQ-C30, EORTC-QLQ-OV28
Visite de fin de traitement
- Examen clinique, biologique
- ECG
- Scanner ou IRM
- Questionnaires de qualité de vie EORTC-QLQ-C30, EORTC-QLQ-OV28
Follow-Up
- Scanner ou IRM
Critères principaux d’évaluation
PFS, PFS2, OS, TFST
Recherche translationnelle
Des échantillons sanguins seront prélevés à l’inclusion et durant le traitement au J1 tous les 3 cycles durant la thérapie à base de sels de platine (J1C1, J1C4) et durant le traitement de maintenance (J1C1, J1C4, J1C7, J1C10 …) pour l’analyse des biomarqueurs (incluant l’ADN tumoral circulant et les cellules tumorale circulantes).
Les échantillons suivants seront collectés pour déterminer la valeur prédictive ou pronostic de certains biomarqueurs (comme le statut p53 et les ligands de la protéine HSP90) ainsi que pour confirmer le diagnostic du cancer ovarien :
- Tissu tumoral archivé provenant du diagnostic initial (FFPE) collecté avant tout traitement (obligatoire) ;
- Echantillons sanguins à l’inclusion et durant le traitement (par sel de platine et traitement de maintenance) ;
- La collection de tissu tumoral (FFPE ou tissu fraichement congelé) de la rechute actuelle est recommandée si techniquement réalisable.







