La stadification
Pourquoi et comment définir un stade de cancer ?
Selon les résultats de l'examen clinique et de la biopsie, certains examens d'imagerie médicale peuvent être réalisés. Des analyses sanguines peuvent aussi être effectuées pour permettre de faire un bilan de santé et de détecter si le cancer s'est étendu à certains organes.
C’est un code standard international par lequel les équipes de cancérologie décrivent l'extension d'un cancer. Le système appliqué est le TNM (de l' American Joint Committee on Cancer ).
- La lettre T (Tumeur) suivie d'un chiffre allant de 0 à 4 se réfère à la profondeur atteinte par la tumeur. Par exemple, les tumeurs classifiées T4 sont les plus grosses et sont étendues aux tissus adjacents.
- La lettre N (ganglion ou Node en anglais) suivie d'un chiffre allant de 0 à 3 indique si le cancer s'est étendu aux ganglions lymphatiques situés près du colon
- La lettre M Métastase) suivie d'un 0 ou d'un 1 indique si le cancer s'est étendu ou non à des organes distants (s'il a métastasé par exemple dans les poumons ou dans les os) ou aux ganglions lymphatiques qui ne sont pas près du côlon.
Les caractéristiques TNM attribuées au cancer, peuvent être regroupées en 5 stades. Chaque stade est dénommé par un chiffre romain allant de I à IV : le stade I, le moins avancé et le stade IV, le plus avancé. Le stade 0 correspond aux cancers in situ.
Il existe deux systèmes TNM de stadification : la stadification clinique pré thérapeutique (avant le traitement), désignée par TNM ou cTNM (c indiquant que le stade a été déterminé par l’examen clinique) et la stadification anatomo-pathologique et post chirurgicale désignée par pTNM (p indique que le stade a été donné par l’examen anatomo-pathologique, après examen au microscope de la pièce opératoire ou de biopsie). L’estimation du pronostic est meilleure avec le pTNM qu’avec le cTNM.
Pour bien comprendre le principe de la stadification...
L’importance du développement de la tumeur, à travers les différentes couches de la paroi du colon, est déterminante pour décider la meilleure stratégie thérapeutique à mettre en œuvre. Les cinq couches de tissus, de l’intérieur vers l’extérieur, sont :
- La muqueuse comporte un épithélium de revêtement à majorité de cellules caliciformes qui rentrent dans la muqueuse en cryptes dites de Lieberkühn. Le chorion est riche en tissu lymphoïde (lymphocytes diffus et follicules lymphoïdes débordant vers la musculaire muqueuse). Ce tissu est riche en vaisseaux sanguins qui permettent la récupération des nutriments liés à la fonction d'absorption.
- La musculaire-muqueuse est une mince couche de tissu musculaire lisse.
- La sous-muqueuse est constituée de tissu conjonctif et contient le plexus nerveux de Meissner* ainsi que des vaisseaux sanguins et lymphatiques pour la muqueuse.
- La musculeuse a une disposition générale en deux couches de tissu musculaire lisse : circulaire interne et longitudinale externe. Entre ces deux couches se situe le plexus nerveux d'Auerbach*.
- La tunique externe est une séreuse infiltrée de tissu adipeux.
*Le SNE (système nerveux entérique) possède à la fois des afférences (ou neurones sensitifs) et des efférences (ou neurones moteurs). Il possède en outre un ensemble d'interneurones. Grâce à ces trois types de neurones nécessaires pour induire des arcs réflexes, le SNE est un système autonome capable de régler la majorité de ses fonctions sans aucun contrôle nerveux extrinsèque. Il est organisé en deux plexus principaux : le plexus myentérique (plexus d'Auerbach) et le plexus sous-muqueux (plexus de Meissner)
Classification TNM (8ème édition, 2017)
|
TUMEUR = T |
GANGLIONS = N ( Node ) |
MÉTASTASES M |
|---|---|---|
|
T0 : tumeur non démontrable cliniquement |
N0 : pas ganglion |
M0 pas de métastases |
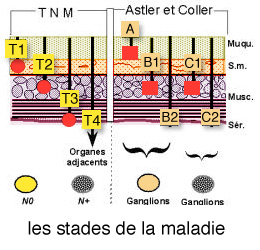
Les différents stades de la maladie (TNM/AJCC 2017)
LE PRINCIPE
Quelque soit le type de classification utilisée par l'équipe soignante, le critère le plus important est la profondeur de la tumeur à travers la paroi du côlon ou du rectum. Ce paramètre est un indice très important car plus la tumeur est profonde, moins bon est le pronostic. De plus, l’extension aux ganglions lymphatiques tend à aggraver également le pronostic.
LES STADES
- Le stade I est caractérisé par une tumeur touchant uniquement la muqueuse, T1 ou une tumeur T2. Il n’y ni ganglion envahi, N0, ni métastase, M0.
- Le stade II à ce stade, la tumeur touche les différentes couches de la paroi du côlon ou du rectum. Il est subdivisé en trois, IIa IIb et IIc
- Le stade III est subdivisé en trois, IIIa, IIIb et IIIc
- Le stade IV correspond à une tumeur (tout T) avec métastases ganglionnaires (tout N) et des métastases à distance, M1.
Au delà de la stadification...
LE PRINCIPE DE LA GRADATION
Le médecin anatomopathologiste examine les tissus prélevés lors de la biopsie ou lors de l'intervention chirurgicale au microscope (examen histologique). Après examen des cellules, il attribue à la tumeur un grade pathologique (p).
Il aide à préciser la stratégie thérapeutique et d'évaluer le pronostic de la maladie. Plus les tumeurs sont indifférenciées, c’est à dire différentes des structures normales, plus elles sont agressives. A l'inverse, plus une tumeur est différenciée, c’est à dire proche de la structure normale, plus son évolution est favorable.
La lettre G (grade) suivie d'un chiffre allant de 1 à 3 indique l’aspect histologique de la tumeur. Ce tube de gradation est utilisé pour les cancers invasifs mais pas pour les cancers in situ.
Les cancers sont parfois désignés comme étant bien différenciés, modérément différenciés ou peu différenciés. Par exemple, les cancers G1 (grade 1) ont des cellules dont l'aspect est relativement normal. Les cellules se multiplient peu (faible nombre de mitoses).
Les cancers G3 , le grade le plus haut, ont des cellules très indifférenciées, un nombre de mitoses est élevé. De nombreuses cellules présentent des anomalies des noyaux cellulaires (ploïdie). Les cancers G2 ont des caractéristiques intermédiaires entre les grades 1 et 3.
LE STROMA
En plus de l'apparence des cellules tumorales, l’aspect du stroma (tissu entourant la tumeur) qui est le reflet de la réaction hôte tumeur est décrit. Un stroma abondant et fibroélastique est en général de bon pronostic. A l'inverse, la présence de zones de nécrose (destruction cellulaire) serait un signe de moins bon pronostic.
LES MARQUEURS TUMORAUX
Des études récentes ont montré que le taux d’ ACE (Antigène Carcino- Embryonnaire) était un facteur pronostic, en particulier pour la localisation rectale. Des études sont en cours pour valider l’utilisation de ce marqueur pour préciser l’utilisation de la chimiothérapie adjuvante.
La mesure du taux d’acide sialique associé aux lipides et du CA-19-9 font l’objet d’études. Leur dosage ne fait pas partie, pour l’instant, du bilan standard.
Des recherches, en cours, tentent de préciser l’importance de l’expression par les cellules du cancer d‘une enzyme : la thymidylate synthétase pour le pronostic.
D'AUTRES PARAMÈTRES
La ploïdie des cellules cancéreuses se réfère à la quantité d'ADN qu'elles contiennent dans leur noyau. S'il y a une quantité normale d'ADN, les cellules sont dites diploïdes. Si le taux d'ADN est anormal, les cellules sont dites aneuploïdes. Certaines études ont montré que les cancers coliques aneuploïdes ont tendance à être plus agressifs. Le pourcentage de phase S pourrait avoir un intérêt pronostic dans certaines formes de la maladie.
Le taux de division des cellules cancéreuses peut aussi être estimé par le test Ki-67. Un index Ki-67 élevé indique que les cellules cancéreuses se divisent rapidement, mais les médecins spécialisés n'accordent pas tous un intérêt à ce test pour déterminer le pronostic de la maladie.
Les données biomoléculaires et génétiques
LE GÈNE KRAS
En deux mots...
Le gène KRAS , cloné en 1982, est situé sur le bras court du chromosome 12 (12p12.1). C'est un oncogène similaire du gène transformant isolé à partir du virus Kirsten RAt Sarcoma , d'où l'acronyme KRAS. Il code pour une protéine de 21 kD localisée sur la face interne de la membrane plasmatique et possède une activité de GTPase*. Cette protéine est une composante essentielle de la cascade de transduction du signal en aval du récepteur membranaire du facteur épidermique de croissance, EGFR .
L'oncogène KRAS joue un rôle important dans la régulation du cycle cellulaire. La stimulation du récepteur EGFR active les cellules tumorales et augmente leur potentiel métastatique.
Son importance
Le KRAS acquiert des mutations activatrices dans environ 40 à 45 % des cancers colorectaux non héréditaires. Ces mutations entraînent une activation constitutive de la voie EGFR (indépendante de la fixation du ligand à son récepteur), en aval du récepteur. Ceci explique pourquoi, les médicaments anti-EGFR sont alors inefficaces.
De manière plus générale, 3 % des sujets ayant une mutation répondent au traitement par les anti-EGFR contre 27 % des sujets n’ayant pas de mutation KRAS .
En pratique ...
Avant l'utilisation d'un médicament anti-EGFR , Erbitux TM ou Vectibis TM , on recherchera la présence de ces mutations sur l'ADN de la tumeur. Après l’extraction de l’ADN de la tumeur, la région cible de l’exon 2 de l'oncogène KRAS est amplifiée par la technique de PCR (Polymerase Chain Reaction) puis séquencée. Seules les mutations au niveau des codons 12 et 13 sont prises en compte pour déterminer le statut (muté ou non-muté) du gène KRAS .
LA MUTATION BRAFV600E
Elle est retrouvée dans 8 % des cancers colorectaux. Elle est associée à une maladie plus sévère, que ce soit au stade localisé ou métastatique. Ces cancers siègent plutôt sur le côlon droit et sont peu différenciés, à composante mucineuse. Ils affectent des sujets âgés et plus souvent des femmes. Ils sont associés à une évolution métastatique ganglionnaire et péritonéale plus fréquente.
Cette mutation va de paire, dans 20 à 40 % des cas, avec une instabilité des microsatellites (MSI) non liée à des formes héréditaires de la maladie.
LES AUTRES FACTEURS
Dans 5 à 10 % des cancers du côlon, un taux trop élevé d'une protéine accélératrice de la croissance appelée HER2/neu ou C-erbB-2
Elle est mis en évidence à la surface des cellules tumorales. Ces cancers ont tendance à se développer et à s'étendre plus agressivement que les autres cancers et pourraient faire l'objet d'un traitement spécifique "anti-HER2".
Le taux de VEGF-A avant l'intervention
Il pourrait représenter un facteur pronostic important. Des valeurs supérieures à 575 pg/ml permettraient d'isoler des patients à haut risque de rechute.
L’intérêt de la mesure d’autres marqueurs moléculaires, comme l’expression due marqueur de l’apoptose bcl2, est à l’étude.
D’autres recherches étudient l’importance, pronostique, du chromosome 18q, en particulier pour les cancers de stade II ou III.
* Les protéines de liaison aux nucléotides de guanine (protéines G) sont appelées GTPases. Elles appartiennent à une superfamille de protéines qui régulent de nombreux processus cellulaires, tels que la signalisation cellulaire, le transport vésiculaire et la régulation de la forme et de la motilité des cellules. La mutation ou le dysfonctionnement de ces protéines peut entraîner un état pathologique, en particulier, un cancer.
LE STATUT MICRO-SATELLITAIRE
LES MICRO-SATELLITES
Ce sont des petites séquences d'ADN...
Elles sont non codantes, réparties aléatoirement dans le génome. Du fait de leur séquence répétitive, elles sont particulièrement exposées aux erreurs de réplication. Elles sont aussi les témoins d'un dysfonctionnement cellulaire au cours de la réplication, étape intervenant avant la division cellulaire et assurant le dédoublement de l'ADN. En effet, au cours de la réplication de l'ADN, se glissent fréquemment des erreurs d'appariement des bases induisant des erreurs de séquence au sein de l'ADN répliqué.
Lors du processus normal, ces erreurs sont automatiquement corrigées, en cours de réplication, par un ensemble coordonné de protéines, les protéines du système MMR (MisMatch Repair). Cette correction assure ainsi la préservation de la séquence de l'ADN qui sera transmis aux cellules filles.
Lorsque le système de réparation des erreurs de réplication est défaillant...
On retrouve, au niveau des microsatellites répliqués, des erreurs se traduisant le plus souvent par un nombre de répétitions des nucléotides non conservé, soit plus élevé soit plus faible par rapport à la séquence originale du microsatellite considéré.
Le système de réparation des mésappariements de l’ADN (MMR) permet de repérer et réparer les erreurs d’appariements nucléotidiques du brin d’ADN nouvellement synthétisé. Le système MMR est indispensable au maintien de l’intégrité génétique.
Dans les tumeurs, ce système MMR peut être défaillant, permettant la survenue d’anomalies génétiques très nombreuses dans les cellules tumorales et conduisant à une instabilité de l’ADN avec accumulation de mutations somatiques (c’est-à-dire présentes dans les cellules tumorales), en opposition aux mutations constitutionnelles (présentes dans toutes les cellules de l’individu). Les microsatellites, séquences d’ADN formées par une répétition de motifs nucléotidiques d’une à quatre paires de base, sont particulièrement touchés par cette instabilité. L’instabilité des microsatellites est une manifestation phénotypique d’une défaillance du système MMR. Ces variations de séquence identifiables par techniques de biologie moléculaire se dénomment, instabilité micro-satellitaire (IMS).
L’INSTABILITÉ MICRO-SATELLITAIRE (IMS)
Définition
C’est un état dans lequel un allèle d’une lignée germinale a gagné ou perdu des motifs répétitifs ce qui se traduit par une modification de taille du chromosome. Lorsqu’il existe une instabilité des séquences de certains morceaux d’ADN, la possibilité qu’à une cellule de réparer son ADN diminue.
Quelle importance pour le cancer du côlon ?
La recherche d'IMS d'une tumeur du côlon est réalisée à partir d'un fragment d’ADN tumoral que l’on compare à l'ADN constitutionnel extrait de lymphocytes périphériques ou de tissu colique sain. Cette technique permet de classifier les tumeurs selon leur stabilité de leur génome : les tumeurs dont le génome est stable sont désignées par l'acronyme SMS et les tumeurs dont le génome est instable (instabilité microsatellitaire) sont appelées IMS+.
Les cancers colorectaux IMS+
Ils seraient de meilleur pronostic que ceux avec stabilité microsatellitaire et, pour les stades II ne nécessiteraient pas de traitement adjuvant. Les cancers SMS seraient plus sensibles à la chimiothérapie adjuvante.
Mise à jour
7 décembre 2023

