Étude COLIBRI
Fiche descriptive de l'étude
Étude Utérus
Étude COLIBRI - Cancer Utérus
Titre de l'étude
COLIBRI : Etude pilote multicentrique évaluant l’impact immunitaire et la sécurité de la combinaison nivolumab et ipilimumab avant le traitement initial par radio-chimiothérapie dans le cancer du col de l’utérus.
Statut
Recrutement terminé / suivi.
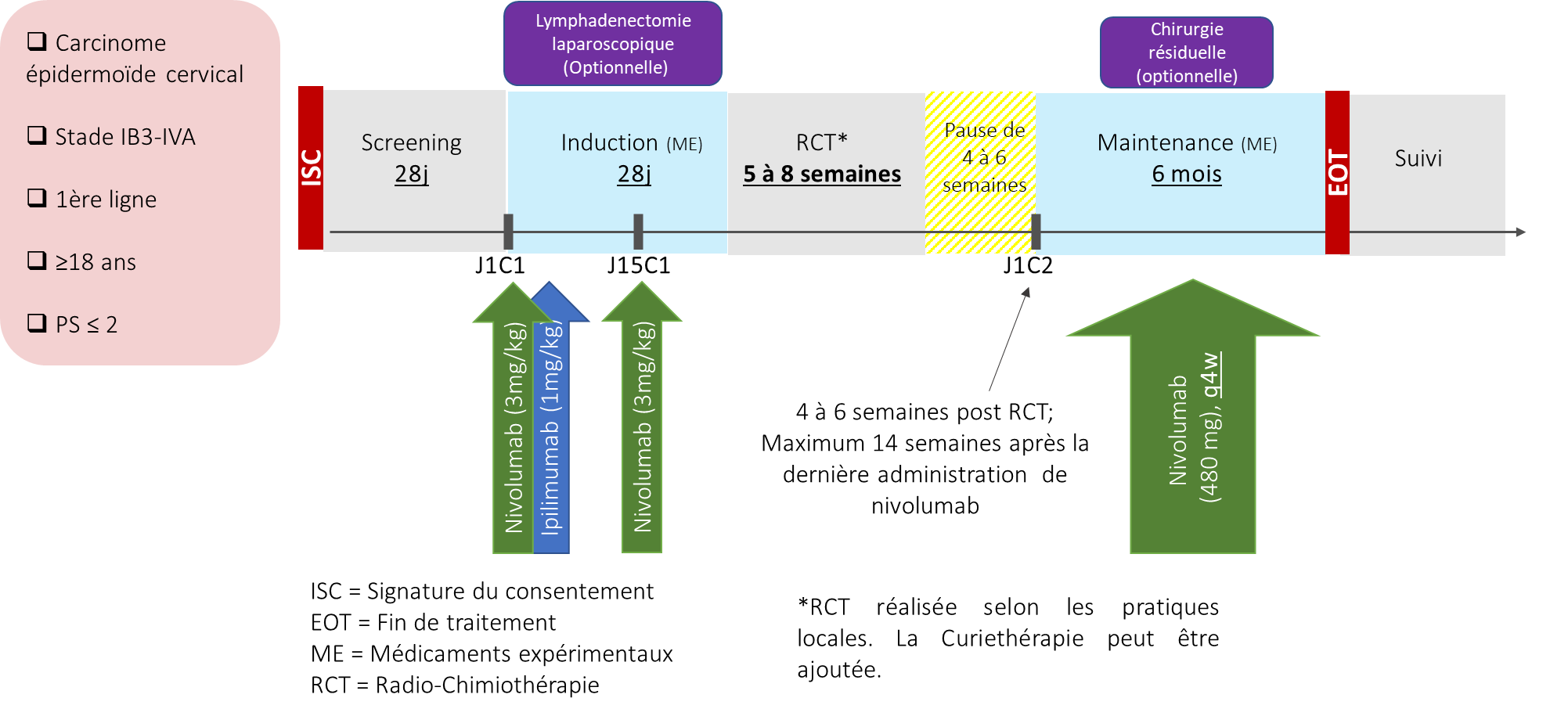
Plan de traitemement de l'étude
Promoteur
ARCAGY - GINECO
Rationnel
De nombreuses études évaluent actuellement différentes stratégies d’immunothérapie dans le cancer du col avancé. Dans ces situations les patientes déjà lourdement traitées n’ont pas toujours les ressources immunitaires pour bénéficier pleinement de l’immunothérapie. De plus, jusqu’à ce jour, aucun biomarqueur de l’efficacité des traitements d’immunothérapie n’a été identifié.
But
Objectif primaire :
Evaluer l’évolution du rapport CD8+/FOXP3+ dans les lymphocytes avant et après traitement, chez les patientes ayant reçu la combinaison nivolumab + ipilimumab, avant la radio-chimiothérapie qui est le traitement standard.
Objectifs secondaires cliniques :
Tolérance, Sécurité, Taux de réponse objective après la radio-chimiothérapie, PFS à 1 an, OS à 3 ans
Objectifs secondaires biologiques :
Évaluer le changement dynamique du micro-environnement immunitaire (profil d’expression génétique, immunomarquage et cytométrie de flux)
Critère principal d’évaluation
- Variation relative du rapport CD8+/FOXP3+ dans les lymphocytes avant et après traitement, à partir des biopsies prélevées avant et après traitement
- Tolérance
- Faisabilité
- Taux de réponse objective (RECIST 1.1) avant et après la radio-chimiothérapie
- Survie sans progression à 1 an
- Survie globale à 3 ans.
Phase
Etude pilote
Type de patiente
Femme adulte avec un diagnostic confirmé histologiquement de carcinome épidermoïde cervical de stade IB3 à IVa (FIGO 2018) n’ayant pas encore traitées par radio-chimiothérapie.
Patientes atteintes d’un cancer du col de l’utérus (d’un stade localement avancé à un stade avancé) n’ayant pas encore traitées par radio-chimiothérapie
Nombre de patientes recrutées
40 patientes dans 8 centres en France
Principaux critères d'inclusion
- Diagnostic d’un cancer du col de l’utérus de stade IB2 à IVa confirmé histologiquement
- Femmes adultes devant être traitées par radio-chimiothérapie dans sa prise en charge
- La patiente devra accepter de réaliser une nouvelle biopsie du col de l’utérus
Principaux critères de non-inclusion
- Patientes candidates pour une chimiothérapie néoadjuvante avant la RT-CT
- Patientes ayant une contre-indication à un traitement par ipilimumab ou nivolumab
- Patientes recevant simultanément d'autres agents antinéoplasiques approuvés ou expérimentaux.
- Affection cardiaque sévère non controlée.
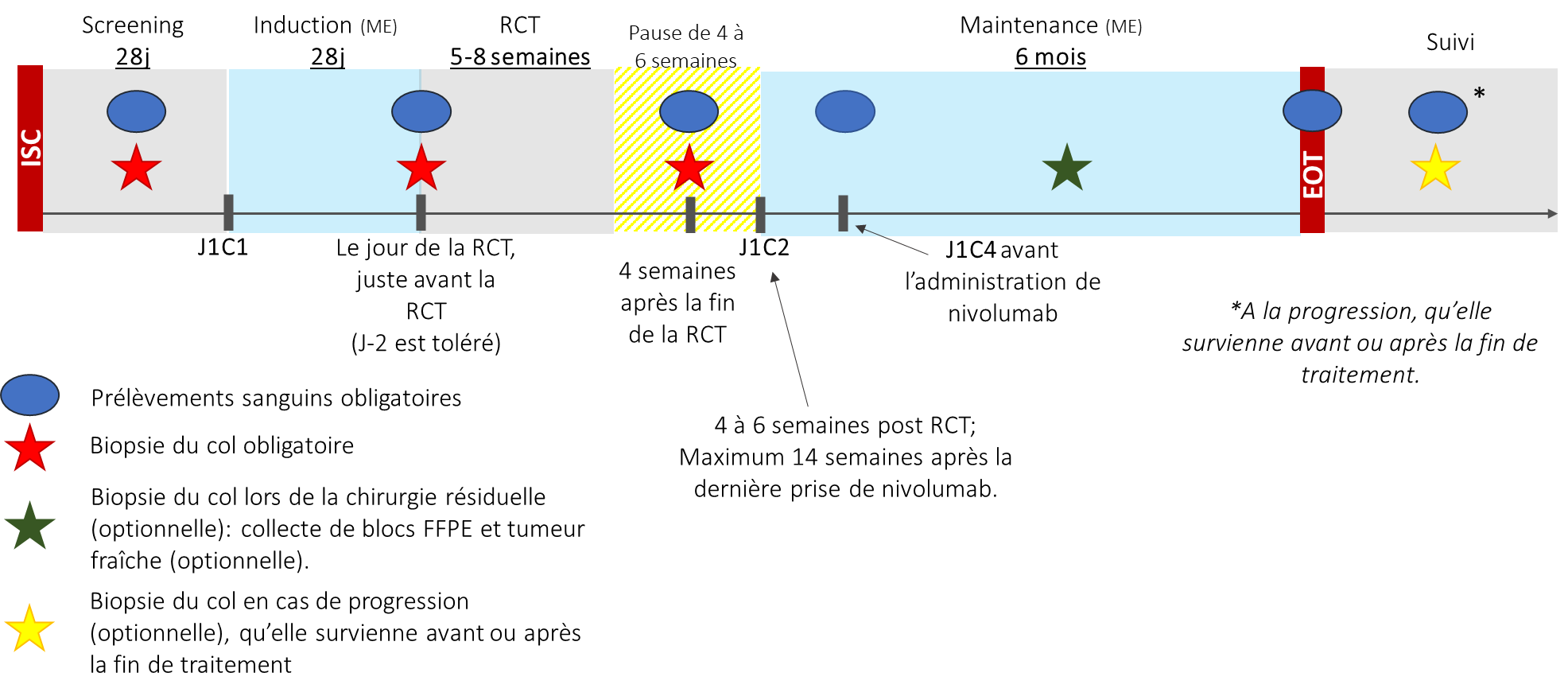
Bilans
Screening
- Examen clinique, biologique, ECG
- IRM ou scanner
- Biopsie du col de l’utérus
Période de traitement
Durant la période d’initiation
- Examen clinique et biologique, ECG à J1 et J15
Durant la période de maintenance
- Toutes les 2 semaines : Examen clinique et biologique, ECG à J1C2
Visite de fin de traitement
15 jours après l’arrêt du traitement :
- Examen clinique et biologique
- Biopsie du col si progression
- IRM ou scanner
Safety Follow-Up
Tous les 6 mois pendant 2 ans puis tous les ans :
- Statut vital
- Recueil des évènements indésirables
Recherche translationnelle