Étude CHIVA - Cancer Ovaire
Fiche descriptive de l'étude
Étude ovaire
CHIVA
Titre de l'étude
CHIVA : Essai randomisé en double aveugle de phase II évaluant le Vargatef® (Nintedanib) en concomitance d'une première ligne de chimiothérapie avec chirurgie d'intervalle chez les patientes présentant un cancer de l'ovaire, de la trompe ou du péritoine. (CHIVA - CHIrurgie VArgatef).
Statut
Clôturée
Plan de traitement de l'étude
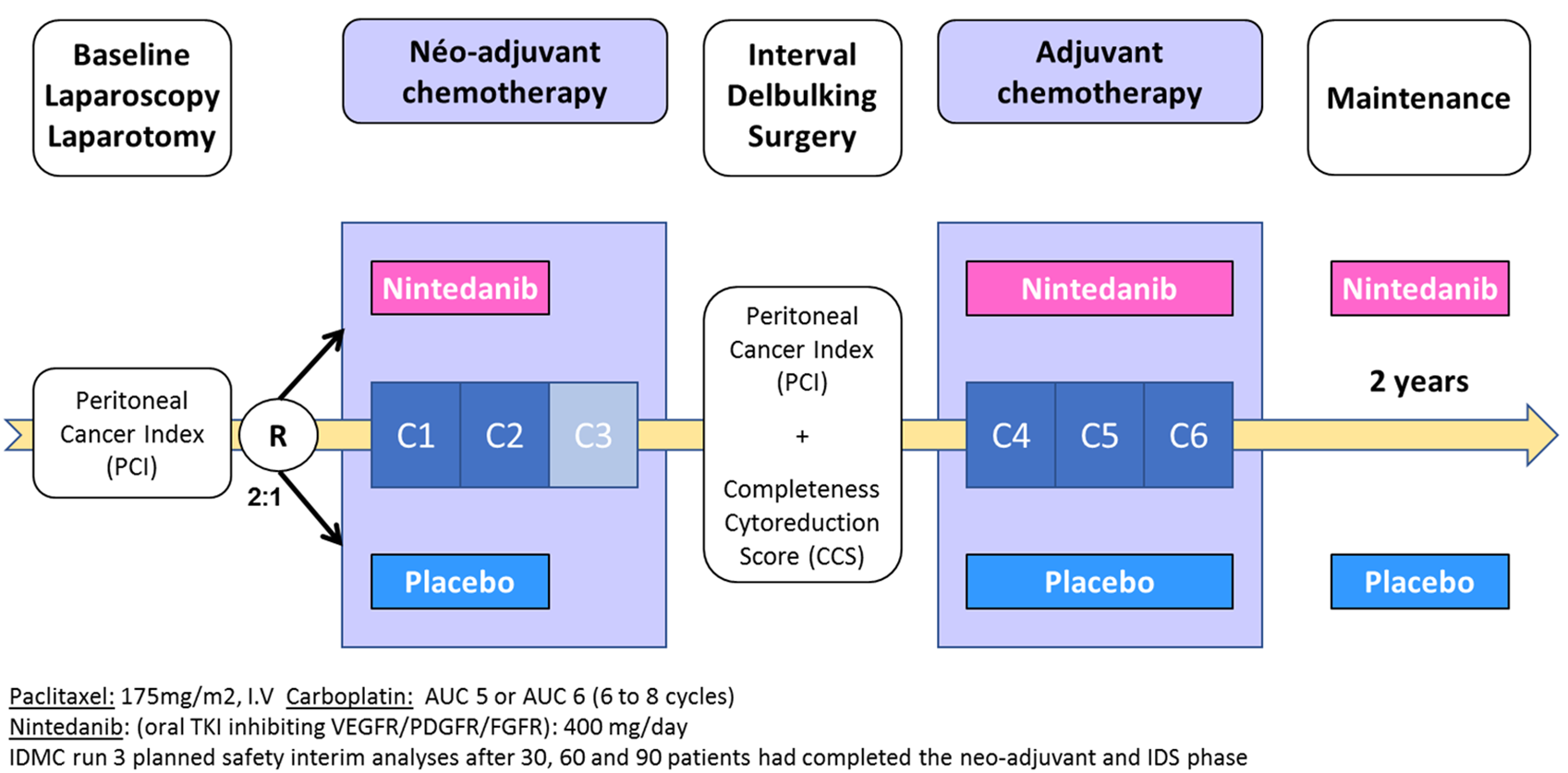
Promoteur
ARCAGY - GINECO
But
L'utilisation du Vargatef® (Nintedanib) en combinaison avec la chimiothérapie néo-adjuvante et adjuvante qui encadre la chirurgie d'intervalle, lorsque cette dernière est indiquée, permettrait, avec sécurité pour les patientes, d'améliorer l'efficacité de la chimiothérapie et d'augmenter les possibilités de réaliser une exérèse complète des lésions tumorales lors de la chirurgie d'intervalle.
Objectif Primaire :
- La médiane de survie sans progression de la maladie (PFS - critères RECIST 1.1).
Objectifs Secondaires :
- Objectifs de tolérance :
- Le taux de complications opératoires et postopératoires.
- Objectifs d'efficacité :
- Le taux de réponse (critères RECIST 1.1) des 2 premiers cycles du traitement néo-adjuvant (chimiothérapie +/- Vargatef® (Nintedanib)),
- Le taux de réponse chirurgicale du traitement néo-adjuvant (en utilisant l'indice de Sugarbaker),
- Le taux de réponse à la stratégie globale comportant traitement néo-adjuvant et chirurgie d'intervalle (critères RECIST 1.1 à la visite de fin de traitement adjuvant),
- L'intervalle libre sans progression biologique (PFIbio) selon les critères GCIG basé sur le CA-125,
- La survie globale,
- La qualité de vie.
- Autres objectifs :
- Identifier les biomarqueurs pouvant prédire l'efficacité (PFS, taux de réponse et le taux de résection complète de la chirurgie d'intervalle), la toxicité du Vargatef® (Nintedanib) et la morbidité de la chirurgie d'intervalle.
- Evaluer l'efficacité du Vargatef® (Nintedanib) par CT scan dynamique après deux cycles, et par TEP-Scan avant traitement et après un cycle de traitement
Phase
Phase II
Type de patiente
- Patiente nouvellement diagnostiquée d'un adénocarcinome de l'ovaire, de la trompe ou péritonéal primitif, histologiquement confirmé. L'histologie devra être obtenue par coelioscopie (ou par laparotomie).
- Stade FIGO IIIC - IV,
- Femmes âgées de 18 ans ou plus,
Nombre de patientes recrutées
188 patientes
Critère principal d’évaluation
- Toxicités selon les critères CTCAE v4.03,
- Taux de complications selon la classification Clavien-Dindo,
- Efficacité selon les critères RECIST1.1 et l'index Sugarbaker,
- Questionnaire de qualité de vie : FOSI.







