Étude NEOPEMBROV - Cancer Ovaire
Fiche descriptive de l'étude
Étude ovaire
NEOPEMBROV
Titre de l'étude
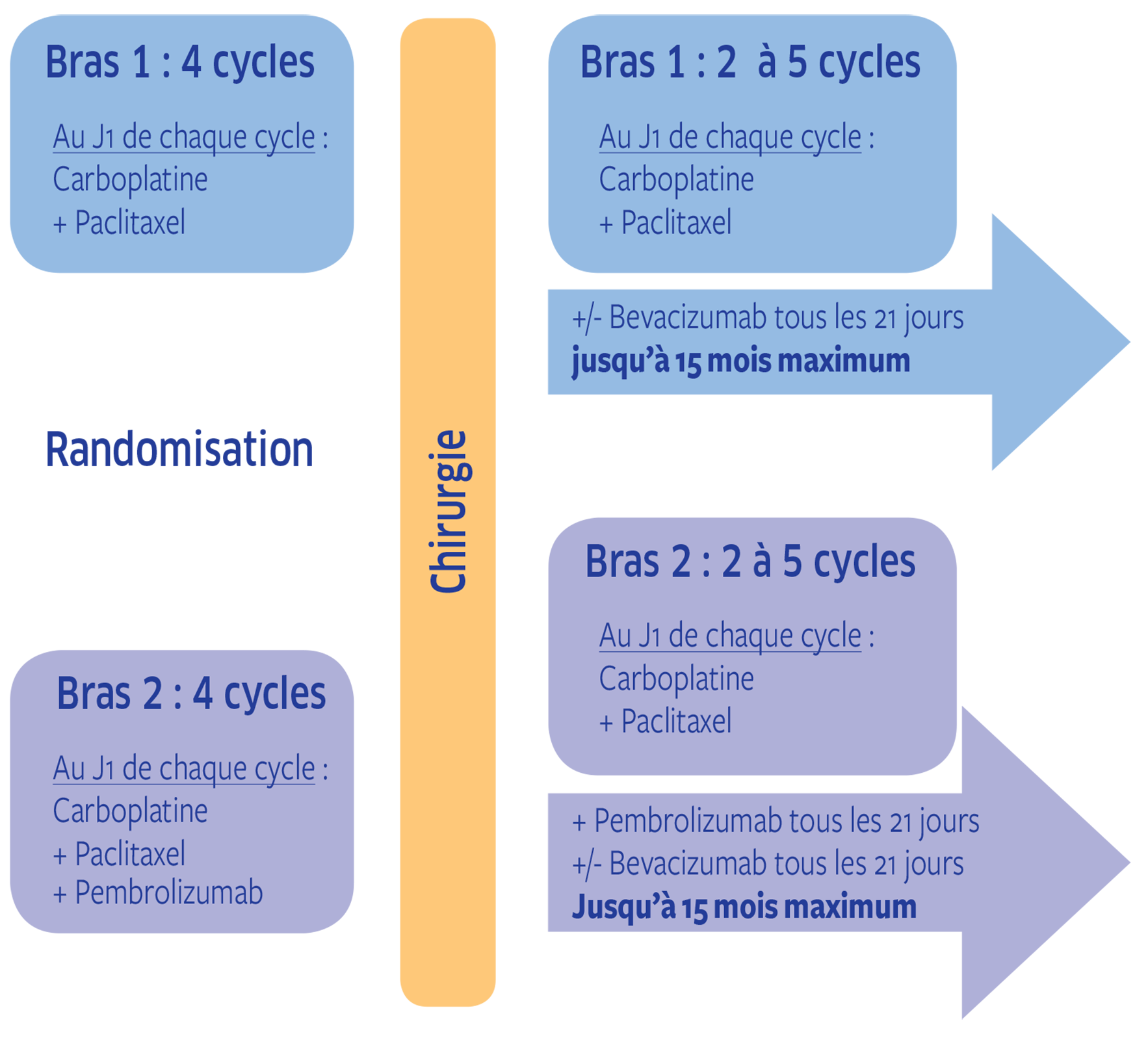
NEOPEMBROV : Etude de phase II multicentrique randomisée, ouverte, évaluant l’ajout du Pembrolizumab (Keytruda) à une chimiothérapie standard vs chimiothérapie seule, en traitement néo-adjuvant chez des patientes présentant un adénocarcinome de l’ovaire non éligible pour une chirurgie d’emblée.
Statut
Recrutement terminé / Publication
Plan de traitement de l'étude NEOPEMBROV
Sponsor / Promoteur
ARCAGY-GINECO
But
Objectifs primaires
Le but de l’essai est de comparer entre les 2 bras de traitement les objectifs suivants : évaluer l’efficacité d’une chimiothérapie associée ou non au Pembrolizumab en néoadjuvant par l’évaluation du taux de résection complète après la chirurgie d’intervalle (IDS) selon une revue médicale centralisée. Une résection complète étant définie par l’exérèse de toute tumeurs macroscopiques (CC0).
Objectifs secondaires
- Objectifs d’efficacité :
- Score CCI évalué par les centres investigateurs et la revue médicale centralisée
- Score PCI évalué par les centres investigateurs et la revue médicale centralisée- Taux de réponse (critères RECIST 1.1) des 4 premiers cycles du traitement néo-adjuvant (chimiothérapie +/- Keytruda® (Pembrolizumab),
- Taux de réponse du pCR évalué par la revue médicale centralisée
- Taux de réponse à la stratégie globale de chirurgie d’intervalle avec chimiotherapie + /- Pembrolizumab évaluée par CT scan en utilisant les critères RECIST 1.1 à la visite de fin de traitement adjuvant et avant la chirurgie d’intervalle.
- Intervalle libre sans progression biologique (PFIbio) selon les critères GCIG basé sur le CA-125,
- Survie sans progression (PFS) RECIST 1.1
- Survie globale.
2. Objectifs de sécurité :
- Evaluer le profil de sécurité du Pembrolizumab en néoadjuvant et en adjuvant lorsqu’il est combiné avec une chimiothérapie standard, selon le CTC-AE V 4.03,
- Evaluer la mortalité et morbidité postopératoire (score de Clavien Dindo),
Phase
Phase II
Population de l'étude
- Patiente nouvellement diagnostiquée d’un adénocarcinome de l’ovaire, de la trompe ou péritonéal primitif, histologiquement confirmé. L’histologie devra être obtenue par coelioscopie (ou par laparotomie),
- Histologie de haut grade ou endométrïode,
- Stade FIGO IIIC – IV avancé ou patiente non éligible à la chirurgie première pour laquelle une chimiothérapie néo-adjuvante est recommandée. Chirurgie première récusée après évaluation par laparoscopie ou coelioscopie. Les patientes avec des métastases extra-abdominales (Stade FIGO IV), peuvent être incluses si la résection de ces métastases peut être complète,
- Chirurgie d’exérèse initiale non réalisable et planification d’une chirurgie d’intervalle maximale avec pour objectif l’absence de résidu tumoral. L’index de Sugarbaker inférieur à 30 au moment de l’inclusion.
Nombre de patientes recrutées
90 patientes dans environ 22 centres







