Étude INeOV - Cancer Ovaire
Fiche descriptive de l'étude
Étude ovaire
INeOV INeOV (Immunotherapy with Neo-adjuvant chemotherapy for OVarian cancer)
Titre de l'étude
INeOV : Etude de phase III, randomisée en double aveugle comparant atezolizumab versus placebo chez des patientes atteintes d’un cancer de l’ovaire, des trompes ou du péritoine en rechute tardive et traitées par l’association d’une chimiothérapie à base de platine et de niraparib en maintenance
Statut
Recrutement terminé / Suivi.
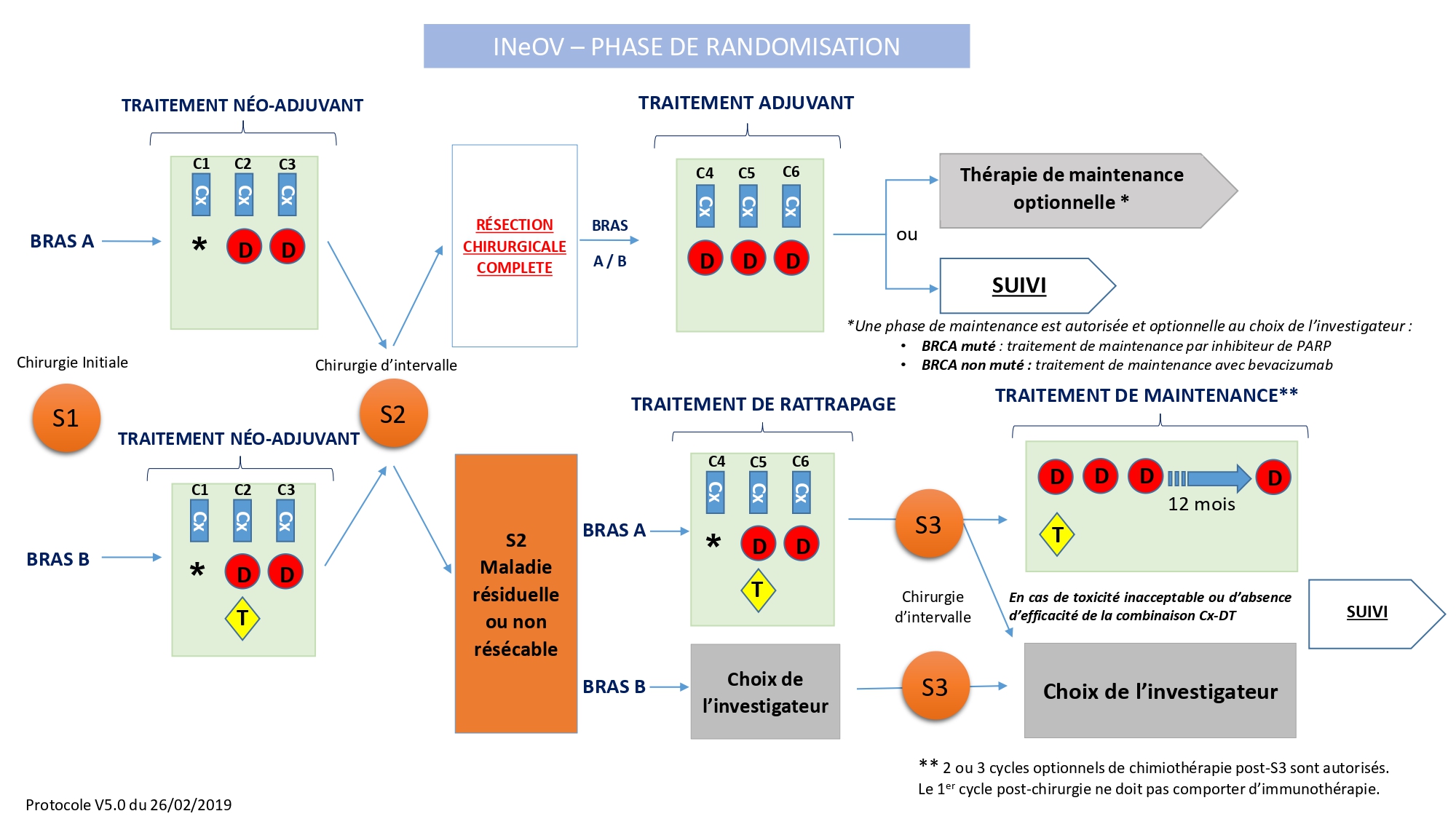
Plan de traitement de l'étude
Promoteur
ARCAGY - GINECO
But
OBJECTIF PRINCIPAL :
Evaluer la sécurité selon le NCI CTCAE v.4.03 et la faisabilité de la combinaison carboplatine et le paclitaxel avec :
- Le durvalumab (bras A)
- Le durvalumab et le tremelilumab (bras B).
OBJECTIFS SECONDAIRES :
Evaluer:
- La capacité du durvalumab (bras A) ou de la combinaison durvalumab + tremelimumab (bras B) associé avec les 3 cycles de chimiothérapie néo-adjuvante carboplatine-paclitaxel de :
- Moduler l’environnement immunitaire des tumeurs ovariennes collectées lors de la chirurgie initiale (S1) et ensuite évaluées lors de la chirurgie d’intervalle (S2) après un traitement systémique néo-adjuvant, en comparant l'expression de PD-L1, TIL, d’autres cellules immunitaires et des molécules immunitaires inhibitrices/agonistes.
- Obtenir une réponse selon les critères RECIST v1.1, diminuer le Sugarbaker Peritoneal Index Score (PCI) à S2 comparé à S1, permettre au chirurgien de réséquer complètement la tumeur (CC0) à S2.
- La sécurité de la chirurgie d’intervalle après un traitement néo-adjuvant comprenant ledurvalumab ou durvalumab+tremelimumab associé à la chimiothérapie. La sécurité sera évaluée selon la classification Clavien-Dindo (Dindo D., 2004).
- La tolérance du tremelimumab ajouté au durvalumab + chimiothérapie et ajouté au durvalumab durant la phase de maintenance (bras A), chez les patientes qui n’auraient pas obtenues une résection complète à la chirurgie d’intervalle (S2) ou n’auront pas pu être opérées à S2.
- La capacité du tremelimumab ajouté à la combinaison chimiothérapie-durvalumab (bras A), pour les patientes n’ayant pas obtenu de résection complète lors de la chirurgie intervallaire (S2) ou n’ayant pas pu être opérées à S2 (thérapie rattrapage), de :
- Moduler le paysage immunitaire de la tumeur ovarienne collectée à S2 et évalué suite à la chirurgie de rattrapage (S3), soit après 3 cycles de traitement systémique post- chirurgie d’intervalle (S2), en comparant l'expression de PD-L1, TIL, d’autres cellules immunitaires et molécules immunes d'inhibition / agoniste.
- Obtenir une réponse selon les critères RECIST v1.1, diminuer le Sugarbaker Peritoneal Index Score (PCI) évalué à S2 et S3, permettre au chirurgien de réséquer complètement la tumeur (CC0) à S3.
- L’efficacité de la stratégie globale combinant l’immunothérapie à la chimiothérapie comme stratégie néo-adjuvante dans le cancer de l’ovaire. L’efficacité sera évaluée par le taux de réponse objective selon le RECIST v1.1 à la fin de la stratégie de chimio-immunothérapie, la survie sans progression (PFS), le délai pour l’initiation du premier traitement ultérieur (TFST) et la survie globale (OS). La corrélation du statut PD-L1 et d’autres biomarqueurs prédictifs dans les échantillons tumoraux prélevés à la baseline avec les critères d’efficacité (ORR, résultats des différentes chirurgies, PFS, OS).
La corrélation du statut PD-L1 et d’autres biomarqueurs prédictifs dans les échantillons tumoraux prélevés à la baseline avec les critères d’efficacité (ORR, résultats des différentes chirurgies, PFS, OS).
Critères principaux d’évaluation :
Toxicité : évaluée selon le NCI CTCAE v.4.03. Faisabilité : capacité des patientes à recevoir 3 cycles néo-adjuvants de chimio-immunothérapie dans une période inférieure à 12 semaine
Phase
Phase I/II
Type de patiente
Patientes présentant un cancer épithélial de l’ovaire (incluant les patientes avec un cancer péritonéal primaire ou des trompes) qui sont candidates à une chimiothérapie néo-adjuvante de première ligne.
Nombre de patientes recrutées :
69 patientes dans environ 20 centres.







