Étude AGO-OVAR 2.29
Fiche descriptive de l'étude
Étude ovaire
AGO OVAR 2.29
Titre de l'étude
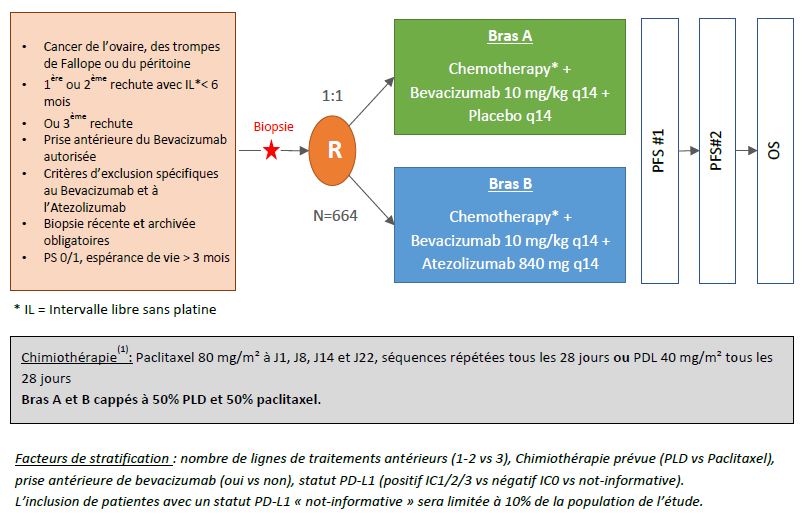
AGO OVAR 2.29 : Etude de phase III, randomisée, en double-aveugle comparant l’atezolizumab versus placebo combiné au bevacizumab et à la chimiothérapie chez les patientes atteintes d’un cancer épithélial de l’ovaire, des trompes de Fallope ou du péritoine, en rechute résistante au platine.
Statut
Clôturée
Plan de traitement de l'étude
Promoteur
AGO Research Gmbh
ARCAGY-GINECO, représentant du promoteur en France
But
Objectif principal
Evaluer l’efficacité et la sécurité de l’ajout de l’atezolizumab comparé au placebo, à l’association bevacizumab + chimiothérapie sans sels de platine, chez des patientes atteintes d’un cancer de l’ovaire, des trompes de Fallope ou du péritoine, en rechute précoce après une 1ère ou une 2ième ligne de traitement à base de platine, ou en 3ième rechute.
Objectifs secondaires
- Evaluer la qualité de vie et les symptômes des patientes (PRO) par les questionnaires EORTC QLQ-C30, QLQ-OV28, PRO-CTCAE, dans des sous-groupes prédéfinis (symptomatique vs asymptomatique), temps jusqu’à détérioration ;
- Pour les patientes du sous-groupe symptomatique : déterminer l’impact de l’atezolizumab comparé au placebo en association avec la chimiothérapie sans sels de platine et le bevacizumab, sur les symptômes abdominaux du cancer ovarien reportés par les patientes, à l’aide de deux items de l’échelle abdominale/gastro-intestinale, présente dans le questionnaire EORTC QLQ-OV28.
Autres objectifs :
- Evaluer les symptômes fonctionnels des patientes et la qualité de vie relative à la santé (HRQoL) associés à la prise d’atezolizumab en comparaison au placebo en association avec la chimiothérapie sans sels de platine et le bevacizumab, à l’aide des échelles fonctionnelles et HRQoL du questionnaire EORTC QLQ-C30
- Evaluer le taux de réponse objective (ORR) et la durée de la réponse (DOR)
- Evaluer l’efficacité concernant la survie globale (OS), la survie sans progression (PFS), le taux de réponse objective et la durée de la réponse (ORR/DOR), selon le statut PD-L1 positif défini par le test VENTANA SP142 (negatif : IC 0 vs positif IC : 1/2/3)
- Evaluer la sécurité et la tolérance de l’ajout d’atezolizumab comparé au placebo, en association avec la chimiothérapie sans sels de platine et le bevacizumab
- Déterminer le délai entre la randomisation et le début d’un nouveau traitement après la progression (TFST)
- Déterminer le délai entre la randomisation et le début du traitement pour une seconde progression (TSST)
- Analyses en fonction du niveau de LDH au début du traitement (valeurs normales vs élevées).
Critères principaux d'évaluation
- Survie Globale, définie par le délai entre la randomisation et le décès
- Survie sans progression, définie par le délai entre la randomisation et la date de progression de la maladie ou le décès. La progression est évaluée par l’investigateur selon RECIST 1.1
Phase
Phase III
Type de patiente
Femme adulte atteinte d’un cancer ovarien en récidive, d’un cancer des trompes de Fallope ou d’un cancer péritonéal primaire, suite à une 1ère ou 2ème rechute dans les 6 mois après une chimiothérapie à base de platine ou suite à une 3ème rechute.
Nombre de patientes recrutées
574 patientes dans 136 centres au niveau international
144 patientes en France dans 32 centres