Étude ROCSAN
Fiche descriptive de l'étude
Étude ovaire
ROCSAN
Titre de l'étude
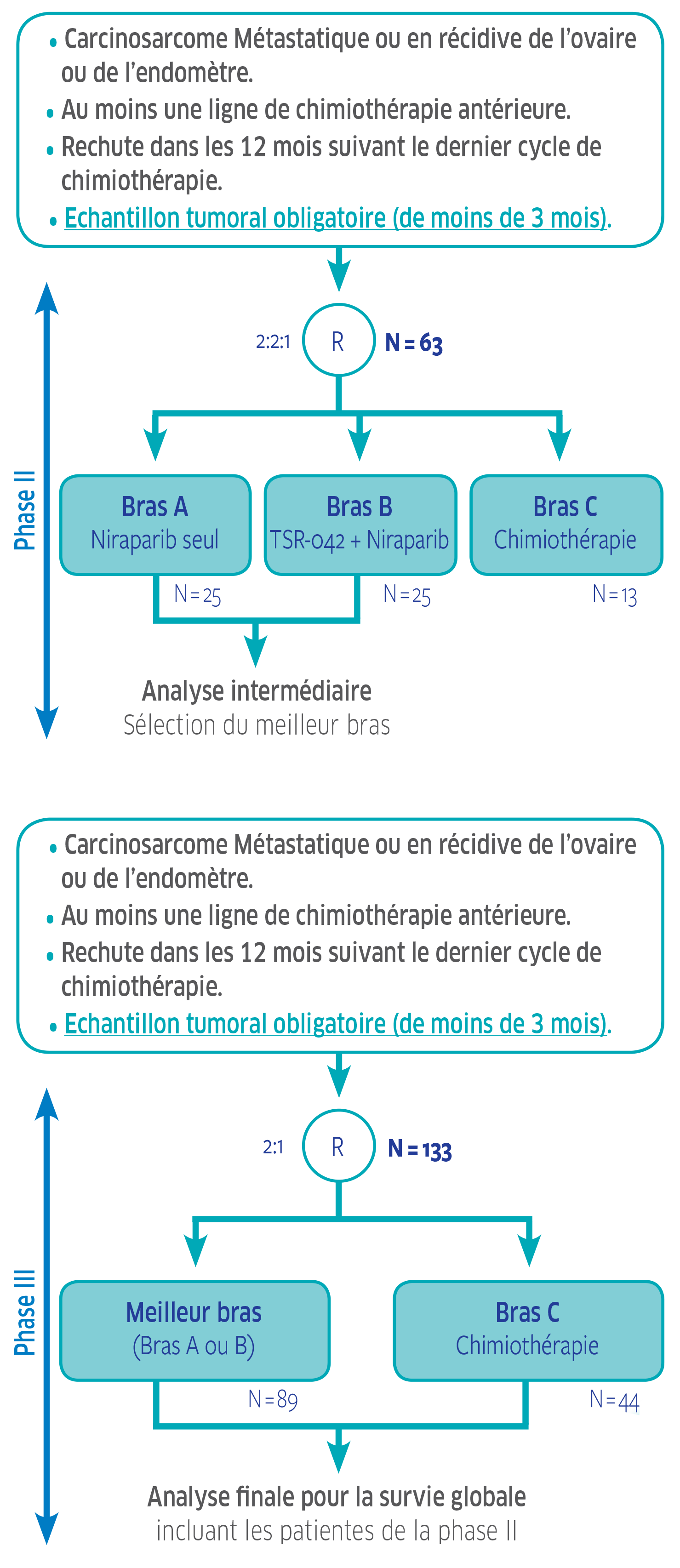
ROCSAN : Etude de phase II/III, randomisée, multicentrique évaluant le dostarlimab associé au Niraparib versus le Niraparib seul comparé à la chimiothérapie chez des patientes atteintes d’un carcinosarcome métastasique ou en récidive de l’ovaire ou de l’endomètre après une chimiothérapie de première intention.
Statut
En cours de recrutement
Plan de traitement de l'étude
Promoteur
ARCAGY - GINECO
But
Objectifs principaux :
-
Phase II – Etape 1 phase de sélection : Sélectionner la meilleure stratégie thérapeutique entre l’association niraparib et dostarlimab, et le niraparib en monothérapie.
-
Phase II - Etape 2 phase d'extension : Evaluer la meilleure stratégie expérimentale chez les patientes ayant un carcinosarcome en progression ou rédicivant de l'endomètre et ayant reçu au moins un traitement a base de platine.
Objectifs secondaires :
- Evaluer la durée médiane de survie globale dans la meilleure stratégie expérimentale
- Approfondir l’évaluation du profil de sécurité global du meilleur bras expérimental
- Evaluer l’activité anti-tumorale de la meilleure stratégie expérimentale
- Evaluer le bénéfice clinique de la meilleure stratégie expérimentale
- Approfondir l’évaluation de la Survie Sans Progression (PFS) et de la 2e Survie Sans Progression (PFS2
- Définie comme le délai entre la randomisation et la seconde progression durant la phase de sélection, et comme le délai entre le début du traitement et la seconde progression durant la phase d’extension) dans la meilleure stratégie expérimentale
- Evaluer les effets des traitements sur les symptômes rapportés par les patientes et la Qualité de vie
Phase
Phase II
Type de patiente
- Etape 1 : Patient adulte avec un état général <1 et un carcinosarcome de l'endomètre ou de l'ovaire métastatique ou récurrent ayant reçu au moins une ligne de chimiothérapie.
- Étape 2 : <1 et avec un carcinosarcome métastatique ou récurrent de l'endomètre ou de l'ovaire ayant reçu au moins une ligne de chimiothérapie.
Nombre de patientes recrutées
138 patientes dans environ 20 centres en France et 20 centres à l'étranger
Critères principaux d'évaluation
- Etape 1 - Phase de sélection Le critère principal est le taux de réponse à 4 mois, défini comme la proportion de patientes avec une réponse partielle (PR) ou une réponse complète (CR) 4 mois après la randomisation. Si le nombre de réponses est insuffisant (un minimum de cinq (5) réponses est nécessaire selon le test exact) lors de la première étape, le recrutement ne se poursuivra pas dans ce bras.
- Etape 2 – Phase d’extension Le critère principal est le taux de patientes en vie à 6 mois (6m-OS) après le début du traitement. Ce taux sera calculé dans la population évaluable pour l’efficacité et représenté par une proportion avec son intervalle de confiance unilatéral à 95%, comme prévu par le design de l’étude







