Étude PembroSCCOHT
- Documents de l'étude PembroSCCOHT en accès professionnel
- Espace Pathologistes - Étude PembroSCCOHT en accès professionnel
Fiche descriptive de l'étude
Étude Tumeurs malignes rares gynécologiques
PembroSCCOHT
Titre de l'étude
PembroSCCOHT : Etude de phase II, multicentrique évaluant le pembrolizumab en combinaison avec une chimiothérapie à base d’étoposide-cisplatine (PAVEP) en première intention chez des patientes atteintes d’un carcinome ovarien à petites cellules avancé de type hypercalcémique.
Statut
En cours de recrutement
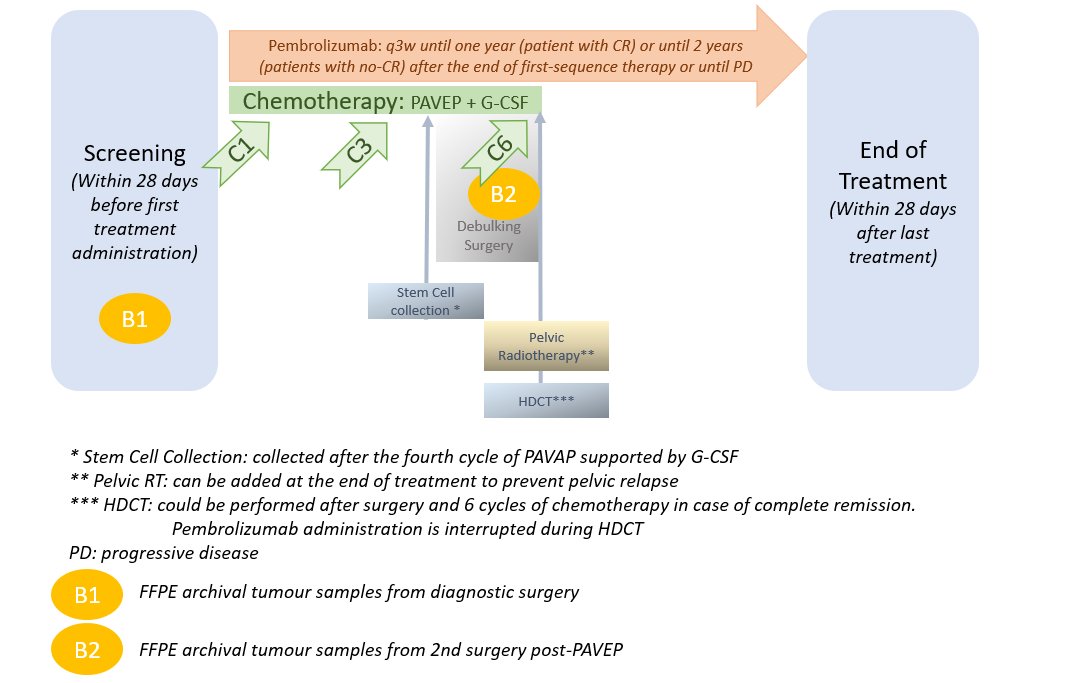
Plan de traitement de l'étude
Promoteur
ARCAGY-GINECO
But
OBJECTIF PRINCIPAL
Evaluer le taux de Réponse complète après un traitement périopératoire par chimiothérapie et immunothérapie (selon RECIST 1.1).
OBJECTIFS SECONDAIRES
- Evaluer la survie globale et la survie sans progression
- Tolérance évaluée par l'échelle NCI CTC AEv5.0
- Réponse partielle à la fin du traitement de première ligne
- Durée de la réponse (DoR) selon RECIST
Phase
Phase II
Type de patiente
Patiente âgée d'au moins 12 ans, ayant un carcinome à petites cellules de l'ovaire non traité et confirmé pathologiquement. Les patientes peuvent être incluse après un cycle de chimiothérapie mais doivent commencer le traitement de l’étude dans les 4 semaines après le premier cycle. Le schéma de l’étude commence au cycle 2 pour ces patientes.
Nombre de patientes recrutées
8 patientes dans environ 12 centres en France
Critères principaux d'évaluation
Le taux de réponse complète est défini comme la proportion de patients qui ont atteint une réponse complète (CR), selon RECIST v1.1. après la phase de traitement initiale comportant la chimiothérapie associée l’immunothérapie et la chirurgie.







