Étude TEDOVA
- Documents de l'étude TEDOVA en accès professionnel
- Espace Pathologistes - Étude TEDOVA en accès professionnel
Localisation : OVAIRES
TEDOVA
Titre de l'étude
Etude de phase II, randomisée, comparant un traitement de maintenance par le vaccin OSE2101 (TEDOPI®), composé de multiples néo-épitopes tumoraux, seul ou en association avec un anti PD1 (Pembrolizumab) par rapport au traitement standard chez des patientes présentant un cancer de l’ovaire en rechute sensible au platine
Statut
Recrutement terminé / Suivi
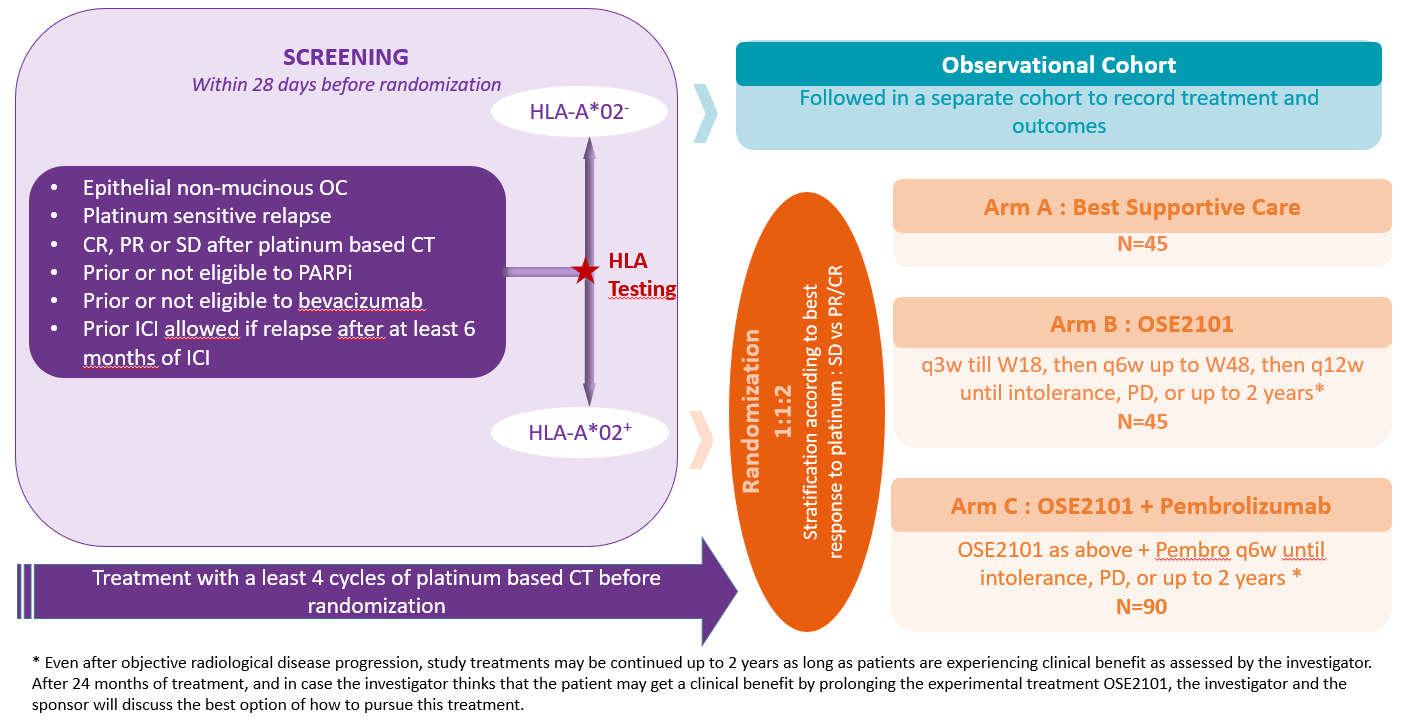
Plan de traitement de l'étude
Promoteur
ARCAGY-GINECO
But
Objectif principal :
Déterminer l’efficacité, en terme de Survie Sans Progression (SSP), d’un traitement de maintenance par le vaccin OSE2101 seul ou en association avec un anti-PD1 chez des patientes atteintes d’un cancer de l’ovaire en rechute sensible aux sels de platine.
Objectif secondaire :
- Comparer le meilleur taux de réponse globale (ORR) chez les patientes avec une maladie mesurable selon RECIST 1.1 à la randomisation
- Evaluer la sécurité et la tolérance d’OSE2101 seul ou en association avec le pembrolizumab selon l’échelle NCI CTC AE v5.0
- Déterminer le délai entre randomisation et initiation du traitement après la rechute (TTST-1)
- Déterminer le délai entre randomisation et second traitement après la rechute (TTST-2)
- Evaluer la Survie globale (OS)
Phase
Phase II
Type de patiente
Patientes atteintes d’un cancer de l’ovaire épithélial non-mucineux en rechute, sans limitation du nombre de chimiothérapies antérieures, sensible au platine, non progressive après leur dernière chimiothérapie à base de platine et non candidate à un traitement d’entretien standard (Bev ou iPARP).
Nombre de patientes recrutées
- 180 patientes dans environ 35 centres
- 120 patientes en France dans 25 centres
Critère principal d’évaluation
La Survie Sans Progression (SSP) évaluée par l’investigateur (selon les critères RECIST1.1)