Étude DOMENICA
- Documents de l'étude DOMENICA en accès professionnel
- Espace Pathologistes - Étude DOMENICA en accès professionnel
Fiche descriptive de l'étude
Étude Utérus
Étude DOMENICA - Cancer Utérin avancé ou rechute
Titre de l'étude
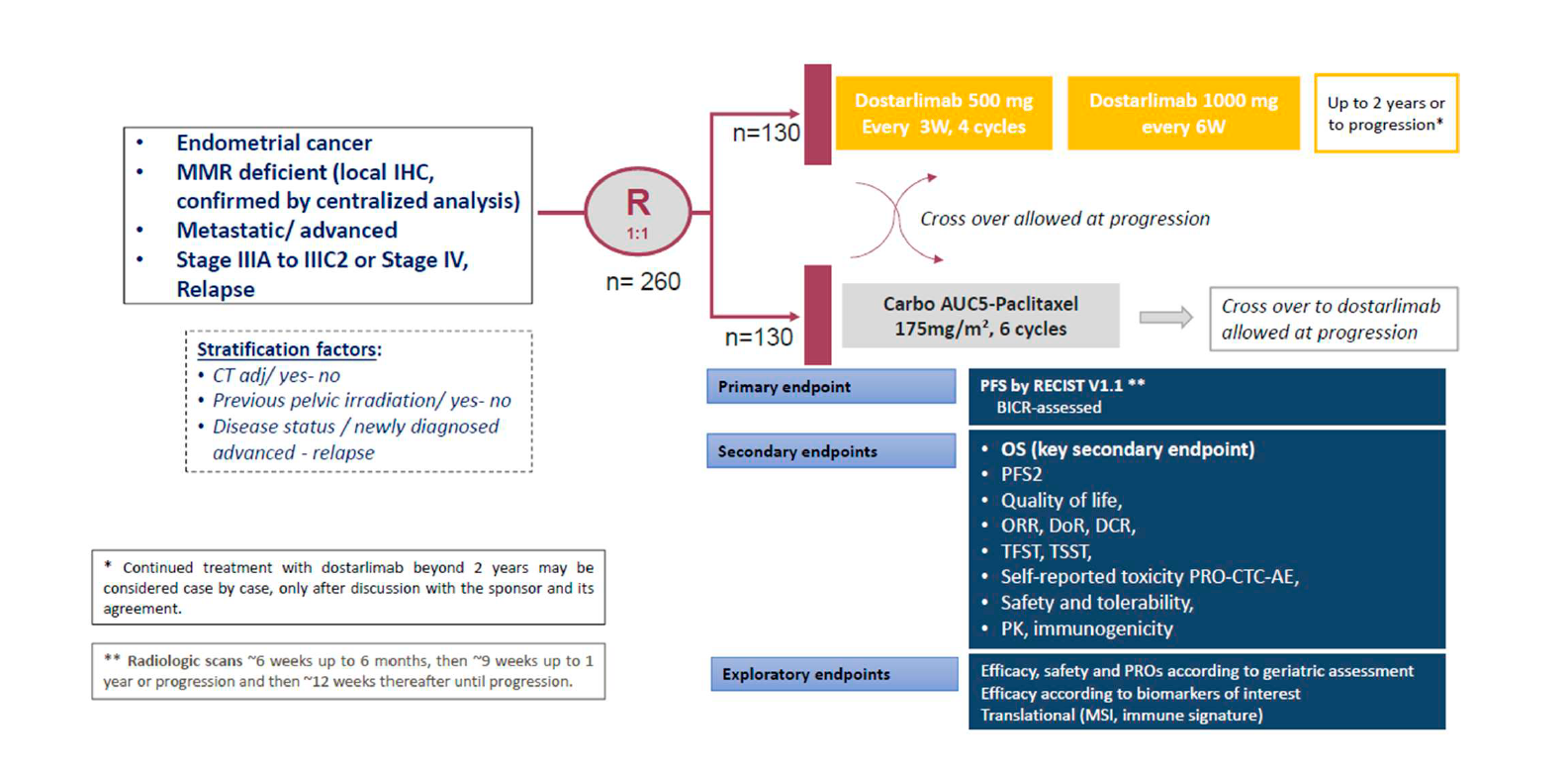
Etude de phase III comparant la chimiothérapie seule versus dostarlimab en première ligne chez les patientes présentant un cancer de l’endomètre avancé ou métastatique, avec une anomalie de réparation de l’ADN (déficit MMR)
Statut
En cours de recrutement
Plan de traitemement de l'étude
Promoteur
ARCAGY - GINECO
But
Objectifs primaires :
La survie sans progression (PFS) évaluée par une revue en aveugle, indépendante, centralisé (BICR) => définie comme le temps entre la date de randomisation et la progression selon les critères RECIST v1.1, ou le décès quel qu’en soit la cause s’il survenait avant la progression. Les patientes vivantes et sans progression seront censurée à la dernière date d'évaluation de la maladie.
Objectifs secondaires :
- Survie globale (OS) définie comme le délai entre la date de randomisation et le décès, quel qu’en soit la cause. Les patientes vivantes à la fin de l’étude seront censurées à la dernière date à laquelle elles sont connues comme étant vivantes.
- Survie sans progression 2 (SSP2/PFS2) définie comme le délai entre la randomisation et la seconde rechute de la maladie selon l’investigateur (i.e. après le premier traitement) ou le décès
- Qualité de vie (QoL) évaluée par les questionnaires EORTC QLQ-C30, EORTC QLQ-CIPN20, EORTC QLQ-EN24 et EUROQOL EQ-5D
- Meilleur taux de Réponse Objective (ORR) Défini comme la proportion de patients présentant une une réponse partielle ou complète selon RECIST v1.1.
- Taux de contrôle de la maladie (DCR) défini comme la proportion des participantes qui ont atteint une CR ou PR ou ont démontré une SD pendant au moins 24 semaines, selon RECIST v1.1 pour les patientes avec une maladie évaluable au début de l’étude.
- Délai de réponse (DoR) durée entre la réponse objective initiale et la progression objective tumorale
- Sécurité et tolérance - Evaluée selon CTCAE v5.0 (par les investigateurs) et selon NCI PRO-CTCAE (par les patientes)
- Délai entre la randomisation et l’initiation du traitement à la rechute (1ère et 2nde rechute), ou le décès.
- Efficacité des seconds traitements systémiques : taux de réponse objective du premier traitement systémique après rechute
- Décrire la pharmacocinétique du dostarlimab : concentrations de sérum et paramètres pertinents de PK (C-EOI at Ctrough) du dostarlimab.
- Déterminer l’immunogénicité du dostarlimab : l’incidence des ADA contre le dostarlimab
Critère principaux d’évaluation
PFS selon Recist 1.1 : Temps entre la randomisation et la progression selon Recist 1.1 ou le décès, selon le premier évènement.
Phase
Phase III
Type de patiente
Patientes présentant un cancer de l’endomètre avancé ou métastatique, avec une anomalie de réparation de l’ADN (déficit MMR).
Nombre de patientes recrutées :
45 patientes dans environ 41 centres
163patientes en France dans 46 centres