Étude RAMP 301
Fiche descriptive de l'étude
Étude ovaire
Étude RAMP 301
Titre de l'étude
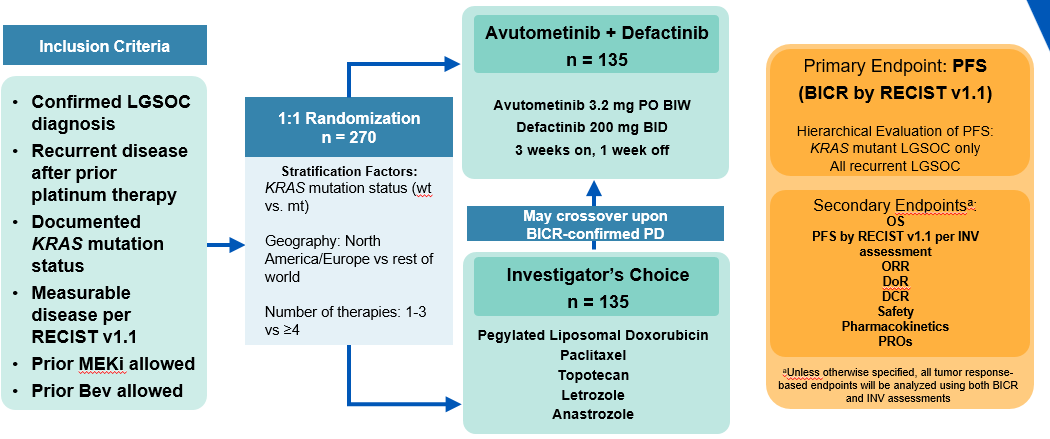
GOG-3097/ENGOT-ov81/NCRI/RAMP 301 Etude de phase 3, randomisée, ouverte, de thérapie combinée avec avutometinib plus defactinib versus le choix de traitement de l'investigateur chez les patients atteints de cancer ovarien séreux de bas grade récurrent (LGSOC)
Statut
Cette étude est en cours de recrutement
Schéma de l'étude
Promoteur
Verastem
But
Objectif principal
Comparer la survie sans progression (PFS: Progression Free Survival) de la combinaison d'avutometinib et de defactinib par rapport au choix du traitement par l'investigateur (ICT: Investigator’s Choice of Treatment) chez les patients atteints de LGSOC récurrent.
Objectifs secondaires
- Comparer la combinaison d'avutometinib et de defactinib par rapport à l'ICT chez les patients atteints de LGSOC récurrent en ce qui concerne les paramètres d'efficacité supplémentaires.
- Caractériser la sécurité et la tolérabilité de la combinaison d'avutometinib et de defactinib chez les patients atteints de LGSOC récurrent.
- Déterminer l'exposition à l'avutometinib et au defactinib chez les patients atteints de LGSOC récurrent traités avec la combinaison d'avutometinib plus defactinib.
- Évaluer la qualité de vie liée à la santé et les symptômes liés à la maladie chez les patients atteints de LGSOC récurrent traités avec la combinaison d'avutometinib plus defactinib par rapport à l'ICT
Critères principaux d'évaluation
Pincipaux : Survie sans progression (PFS) selon les critères d'évaluation de la réponse dans les tumeurs solides (RECIST) version 1.1, par revue centralisée indépendante en aveugle (BICR)
Secondaire :
- Sauf indication contraire, tous les critères d'évaluation basés sur les tumeurs seront analysés en utilisant à la fois les évaluations du BICR et de l'investigateur :
1- Survie globale (OS)
2- PFS selon RECIST v1.1, par évaluation de l'investigateur
3- Taux de réponse objective (ORR : Objective response rate)
4- Durée de la réponse (DoR : Duration response rate)
5- Taux de contrôle de la maladie (DCR : Disease control rate), défini comme ayant atteint la meilleure réponse de réponse complète (CR : Complete response) ou de réponse partielle (PR : Partial response), ou une maladie stable (SD : Stable disease) documentée à ≥ la semaine 24.
- Incidence et gravité des événements indésirables (AE), y compris les anomalies de laboratoire, les signes vitaux et les anomalies à l'examen physique, classés selon les critères terminologiques communs du NCI pour les événements indésirables (NCI CTCAE), version 5.0. Un système de notation spécial sera utilisé pour l'évaluation des toxicités oculaires.
- Paramètres pharmacocinétiques de l'avutometinib, du defactinib, et des métabolites pertinents dérivés de l'analyse pharmacocinétique populationnelle (popPK).
- Questionnaires de qualité de vie (QOL) de l'Organisation Européenne pour la Recherche et le Traitement du Cancer (EORTC) QLQ-C30 et EORT QLQ-OV28
Phase
Phase III
Type de patientes
Femme dont l'âge est supérieur ou égal à 18 ans atteinte d'un cancer ovarien séreux de bas grade récurrent (LGSOC)
Nombre de patientes prévues
270 patientes à l'international dans environ 75 centres