Radiothérapie
LA RADIOTHÉRAPIE EXTERNE (RTE)
LE PRINCIPE...
Les rayons, utilisés dans le traitement du cancer, sont appliqués à l’extérieur du corps.
Deux techniques de radiothérapie peuvent vous alors être proposées, selon les équipes soignantes et l'équipement de l'hôpital ou de la clinique :
- La radiothérapie conformationnelle qui réduit le risque de complications tardives,
- la radiothérapie conformationnelle avec modulation d’intensité (RCMI) guidée par l’image (IGRT)
LA RADIOTHÉRAPIE CONFORMATIONNELLE (RTC3D)
En bref...
Elle est définie comme étant une irradiation externe dans laquelle le volume traité est adapté au volume cible reconstruit en trois dimensions grâce aux techniques d'imagerie médicale.
La dose totale est délivrée en un nombre limité de séances (fractions).
Le rayonnement utilisé fait appel aux photons de très haute énergie (> 10 Mv) d’un accélérateur linéaire.
Cette technique d’irradiation permet une escalade de dose sur de petits volumes.
Son intérêt
Les buts recherchés dans le traitement des cancers prostatiques sont de deux ordres :
- De diminuer la toxicité tardive en protégeant au maximum les organes à risque, en particulier la vessie et le rectum
- D'améliorer le contrôle local de la maladie et, par là même, la survie, en augmentant la dose totale délivrée à la prostate
RADIOTHÉRAPIE CONFORMATIONNELLE AVEC MODULATION INTENSITÉ (RCMI)
En bref...
En délivrant une dose hétérogène dans différents volumes au cours d’une même séance, cette technique est beaucoup mieux tolérée.
Le nombre total de séances varie de 30 à 35 fractions. Selon l’étalement total, il existe plusieurs modalités d'administration :
- La RCMI en deux temps et fractionnement constant
- La RCMI avec boost , c 'est à dire une dose concentrée délivrée à l’emplacement de la tumeur, intégré (SIB)
- La RCMI avec une accélération modérée (SMART)
Son intérêt...
Cette approche permet une meilleure conformation que les approches conformationnelles dans les cancers de la prostate.
Les indications de la radiothérapie externe
CURATIVE
L'objectif du traitement est de guérir la maladie par la destruction du tissu prostatique par les rayons.
La technologie
S'il s'agit d'une radiothérapie exclusive, elle doit utiliser une technique conformationnelle tridimensionnelle si possible en modulation d’intensité (RCMI) ou "intensity modulated radiation therapy" (IMRT).
La radiothérapie guidée par l’image est nécessaire en cas d’augmentation de dose au-dessus de 74Gy.
Pour les cancers à faible risque (PSA<10 ng/mL)
Le volume-cible doit comporter la prostate et le tiers interne des vésicules séminales. A ce stade, il n’y a pas d’indication à irradier les aires ganglionnaires pelviennes.
La dose doit être supérieure à 76 Gy en radiothérapie conformationnelle ou avec modulation d’intensité et administrée en 35 fractions.
Les protocoles "hypofractionnés" sont une option alternative. La survie sans récidive biologique à 10 ans est, grâce à cette technique, supérieure à 90 %.
Les cancers de risque intermédiaire et de haut risque
La dose délivrée est encore plus élevée grâce aux techniques conformationnelles.
Une radio-curiethérapie peut être proposée.
L'association radiothérapie et hormonothérapie
C'est le traitement de référence des tumeurs localement avancées lorsque l’espérance de vie des patients est supérieure à 5 ans.
Cette modalité permet une augmentation de la survie spécifique, de la survie sans métastase, de la survie sans progression et du contrôle local.
ADJUVANTE OU DE PRÉVENTION
Son objectif
La radiothérapie a comme objectif de détruire toutes les cellules cancéreuses pouvant rester dans la zone opérée et de réduire le plus possible le risque de récidive locale.
Ses modalités
La dose de radiothérapie administrée est de 66 Gy, 5 à 6 semaines suivant l’opération. La dose minimale efficace est de 64 à 66 Gy.
Le volume irradié inclut la loge de la prostatectomie et assez souvent les aires ganglionnaires.
Par rapport à la radiothérapie classique, l es nouvelles techniques permettent un meilleur taux de contrôle biochimique durable et une diminution de la toxicité aiguë et tardive urinaire et digestive de grade 3 et 4 qui n’excèdent pas 5 %.
Les indications
Ce traitement est proposé aux malades opérés pour une tumeur localisée cliniquement, mais chez qui l'examen de la pièce opératoire révèle une extension extra-capsulaire (pT3), avec un taux de PSA détectable, et en l'absence de métastases à distance. Dans ce cas, la radiothérapie peut être utilisée seule ou en association avec une chimiothérapie après une prostatectomie.
La radiothérapie peut aussi s'appliquer aux tumeurs détruites par laser (photo destruction laser). Dans ce cas, c’est une alternative si votre état général contre-indique une intervention chirurgicale et que vous avez une tumeur localisée .
Elle est aussi indiquée à l’occasion d’une rechute biologique, c’est-à-dire lors d’une augmentation du taux du PSA sans signes de récidive locale.
NÉO-ADJUVANTE
Elle est réalisée avant la chirurgie, seule ou en association avec la chimiothérapie ou l’hormonothérapie. Elle est utile pour détruire les cellules cancéreuses et pour réduire la taille de la tumeur. Cette approche est utilisée dans les cas où la tumeur est importante ou difficile à extirper.
LA RADIOTHÉRAPIE DE RATTRAPAGE
Définition
La récidive après chirurgie se traduit par une ré-ascension progressive du PSA. Elle se définit par un taux de PSA supérieur à 0,2 ng/mL et en augmentation à 3 mois d’intervalle alors qu’il était initialement indétectable.
Deux types d'indications
Le cancer est associé à des facteurs de risque de récidive et une prostatectomie radicale a été réalisée. Le PSA post-opératoire inférieur à 0,1 ng/mL, dans ce cas, on pourra vous proposer une radiothérapie de rattrapage précoce plutôt qu’une radiothérapie adjuvante.
La radiothérapie de rattrapage est aussi indiquée en cas de rechute biochimique tardive, elle permet un contrôle dans 60 à 70 % des cas. La dose est de 66 Gy. Elle centrée sur la loge prostatique.
PALLIATIVE
Elle est indiquée pour des tumeurs évoluées sur le plan locorégional et non opérables d’emblée. L'effet sur la douleur est rapide, quasi-constant et durable.
L’irradiation mono-fractionnée (8 Gy en fraction) est l'option le plus souvent retenue en l’absence de fracture visible ou de compression neurologique avérée.
EN PRATIQUE, LA RADIOTHÉRAPIE EXTERNE…
SES CONTRAINTES
La prostate est un organe profond, entouré de structures fragiles : en arrière, le rectum, en avant la vessie, au-dessus l'intestin grêle. Cela souligne l'importance de protéger les organes voisins.
Selon les cas, le volume à irradier peut être soit limité à la prostate, soit étendu aux ganglions régionaux ou aux ganglions lombo aortiques.
LA MISE EN ŒUVRE DU TRAITEMENT
Vous rencontrerez habituellement en consultation un médecin radiothérapeute qui vous examinera et vous expliquera votre traitement, la durée et le rythme des séances.
La consultation avec le radiothérapeute
A la vue de l’ensemble de votre dossier le médecin vous précisera la durée du traitement, le nombre de séances, l’association éventuelle à une chimiothérapie en même temps que le traitement par rayons et les effets indésirables prévisibles pendant le traitement.
Première étape
Le premier temps de la préparation consiste en la confection d’une contention adéquate permettant une reproductibilité parfaite du positionnement du patient à chaque séance. La méthode optimale de contention est toujours discutée, mais il semble qu’une immobilisation des genoux et des pieds soit un minimum requis. Une immobilisation complète du bassin est possible, mais ne paraît pas apporter une meilleure reproductibilité que la précédente.
Un plan de référence est ensuite défini sur le patient, en général par trois points (un antérieur et deux latéraux) qui sont tatoués.
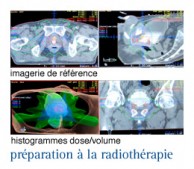
L’imagerie de référence…
Un scanner est alors réalisé, en s’assurant que le plan de référence passe exactement par une des coupes scanner.
Une injection intraveineuse de produit de contraste est très utile pour le repérage de la vessie et des axes vasculaires. Une opacification ou une matérialisation rectale est aussi conseillée.
Les images sont alors transférées sur une console de dosimétrie où, sur chaque coupe, sont contourés le volume prostatique, les vésicules séminales et les organes à risque, rectum et vessie. A ce stade, une reconstruction en « 3D » est alors réalisée
Établissement du plan de traitement et des histogrammes dose-volume
À l’issue du contourage, un plan de traitement (nombre et orientation des faisceaux ; dessins des caches ou position des lames) est proposé au radiothérapeute. L’évaluation de ce plan de traitement est réalisée sur un histogramme dose-volume (HDV).
Certaines contraintes sur la dose reçue par les volumes-cibles et les organes critiques permettent de choisir le meilleur plan de traitement.
Après validation, le plan de traitement est transféré à l’accélérateur linéaire pour la calibration du collimateur multilames.
Durant les 6 à 7 semaines de traitement, des contrôles de qualité, le plus souvent par imagerie portale, sont réalisés à intervalles réguliers.
LES SÉANCES DE RAYONS
Votre installation
Vous serez placé sur la table d'irradiation de la même façon que vous étiez placé lors de la simulation. Vous serez couché sur la table sur le dos (décubitus dorsal) ou, plus rarement, sur le côté (en procubitus). La position de votre corps sera maintenue par une contention : cales sous les genoux et sous les pieds. La position en procubitus nécessite la confection d’un moule thermoformé.
Au cours de la séance, il faut respirer doucement et ne pas bouger.
Les séances
La radiothérapie est habituellement réalisée 1 fois par jour, tous les jours sauf le weekend. Sa durée standard est de 6 à 7 semaines. La durée d'une séance d'irradiation est d'environ 15 minutes, plus courte s’il s’agit d’un protocole dit « hyperfractionné ».
L'irradiation est inodore, invisible, incolore et indolore.
Durant le traitement, vous êtes constamment surveillé à l'aide d'une caméra de télévision et en contact avec l'infirmier(e) par un interphone. La séance peut être interrompue à tout moment si nécessaire. Les paramètres d'irradiation sont constamment contrôlés par un ordinateur. Des radiographies prises pendant la séance contrôlent également votre traitement. Chaque médecin qui vous a pris en charge assurera avec les infirmiers une surveillance clinique, demandera les prises de sang et les radiographies qu'il juge utiles.
Les effets indésirables
Des complications immédiates transitoires urinaires (pollakiurie, hématurie, impériosités mictionnelles, incontinence) ou rectales (diarrhées, rectorragies) sont relativement fréquentes.
De plus...
La moelle osseuse pelvienne est le siège de près de 50 % de l’hématopoïèse totale. La radiothérapie des aires ganglionnaires pelviennes, et des cancers situés à proximité des structures osseuses du bassin, expose à une toxicité hématologique de l’ordre de 30 à 70 %...

La radiothérapie interstitielle (curiethérapie)
LE PRINCIPE
La curiethérapie ou brachythérapie consiste à placer des sources radioactives directement dans le tissu prostatique. Des doses élevées de rayons peuvent ainsi être délivrées sur la tumeur, tout en évitant une irradiation excessive de la vessie et du rectum. Comme le cancer de la prostate est multifocal dans plus de 50 % des cas, tout le volume de la glande doit être traité de façon efficace.
Les techniques dépendent de deux facteurs :
- Le débit de dose de la source radioactive
- Le caractère de l’implant:
- Permanent : la source est laissée dans la prostate ; il s'agit d'une irradiation en bas débit par des grains d'or (AU-98), d'irridium (I-125), de palladium (P-103) ou de césium (Cs-131)
- Temporaire, il s'agit d'un irradiation à haut débit (I-192 ou Co 60)
LA CURIETHÉRAPIE DE BAS DÉBIT
Depuis l’arrêt de la production des sources d’iridium 192 (février 2014 pour l’IRF1 et avril 2014 pour l’IRF2) cela ne permet plus de réaliser des procédures en curiethérapie de bas débit de dose.
LA CURIETHÉRAPIE DE HAUT DÉBIT
Ses indications
Cette technique a été utilisée jusqu’à présent surtout en association à la radiothérapie externe avec pour objectif de réaliser une escalade de dose dans le volume prostatique.
Les aspects techniques
Cette méthode utilise des tubes en plastiques implantés autour de la prostate et secondairement chargés, de façon très transitoire par des fils d’iridium 192. Généralement, elle fait appel à l’utilisation d’un minimum de deux séances de curiethérapie de haut débit de dose avec un protocole de deux à quatre fractions de 3 à 10 Gy chacune délivrées en une ou plusieurs implantations pour une dose totale de 12 à 20 Gy. L’espacement entre les fractions est laissé au choix des équipes. Pour la radiothérapie externe associée, un fractionnement pour une dose totale de 45 à 54 Gy dans la prostate en six à sept semaines est habituel.
En cas de curiethérapie de haut débit de dose seule pour les cancers de pronostic favorable, quatre fractions de 9,5 Gy chacune pour une dose totale de 38 Gy sont proposées.
Cette technique se heurte à des difficultés logistiques en termes de nombre d’actes d’anesthésie, de monopolisation des équipes médicales impliqués et de contrôle de la qualité de l’implant à répéter avant chaque fraction pour vérifier et éventuellement corriger le positionnement des aiguilles.
LES INDICATIONS
Qui est concerné ?
La curiethérapie par implant d'iode 125 est une technique de référence pour le traitement des tumeurs localisées et de faible risque, présentant les caractéristiques suivantes :
- Un volume prostatique < 50 mL
- Une tumeur localisée < T2b
- Un score de Gleason inférieur à 6
- Un PSA inférieur à 10 ng/ml
Les résultats à 10 ans, publiés récemment, étant comparables à ceux obtenus par la prostatectomie radicale, cette méthode pourrait prochainement être étendue à d’autres cas.
Pour les cancers de prostate à très haut risque de rechute biochimique (score de Gleason 9–10)
Le complément d’irradiation en curiethérapie améliore significativement les probabilités de survie sans rechute biochimique et de survie sans métastase et également celle de survie globale à 7 ans, par rapport aux résultats obtenus avec une radiothérapie externe exclusive ou une prostatectomie radicale.
Pour les patients atteints d’une tumeur à risque intermédiaire ou à haut risque de rechute biochimique
Un complément d’irradiation par curiethérapie améliore la survie sans rechute biochimique.
Qui ne peut encore en bénéficier ?
Les principales contre indications de ce type de traitement sont : une résection transurétrale récente, un volume prostatique supérieur à 50 cc ou des troubles sévères pour uriner car ils seront aggravés par ce type de traitement.
La curiethérapie, en pratique ...
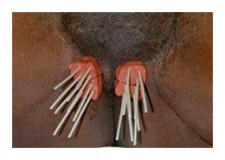
L'IMPLANTATION
Quelques jours avant l'implantation des grains radioactifs, vous êtes convoqué pour une échographie par voie endorectale (planimétrie) pour déterminer d'une part le volume exact de votre prostate et d'autre part de définir le nombre de grains d'iode 125 nécessaires à votre traitement
Vous serez examiné par un médecin anesthésiste lors d'une consultation qui se tient quelques jours avant la curiethérapie. Il vous donnera les explications relatives à l'anesthésie générale nécessaire à la mise en place des grains d'iode.
Vous êtes hospitalisé environ 48 heures dans le service de curiethérapie. La chambre individuelle est située en zone contrôlée. Les visites sont restreintes au seul personnel soignant, vos proches ne peuvent pas vous rendre visite.
Le traitement a lieu en salle d'application de curiethérapie. L'intervention est effectuée sous anesthésie générale. Les grains sont placés de façon définitive par le curiethérapeute, après mise en place des guides par l'urologue.
L'intervention terminée, vous regagnez, selon l'avis de l'anesthésiste, soit votre chambre, soit la salle de réveil pour quelques heures d'observation indispensable.
Une sonde urinaire posée au cours de l'intervention peut donner une sensation désagréable au réveil et l'envie d'uriner. Elle permet de vérifier l'absence de saignement et sert parfois à rincer la vessie. Elle est retirée 24 h plus tard.
À votre départ, l'infirmière du service vous remet :
- Une carte personnelle qui indique la date de la curiethérapie prostatique et les coordonnées du Centre où elle a été réalisée
- Un petit container plombé pour le stockage des grains retrouvés éventuellement lors du filtrage des urines
LES EFFETS SECONDAIRES POSSIBLES …
Vous pouvez parfois ressentir une pesanteur du périnée liée au passage des aiguilles, retrouver quelques traces de sang dans vos urines, ainsi qu'une ecchymose et une sensibilité entre les jambes. Parfois, les urines peuvent être foncées.
Une dysurie, une pollakiurie diurne et nocturne (envies fréquentes), des impériosités (difficultés à se retenir) ou des brûlures mictionnelles sont fréquentes pendant les semaines après l’implantation. Ces problèmes sont maximaux entre 1 et 3 mois et diminueront par la suite très progressivement. Ces symptômes sont en relation avec l’urétrite et la prostatite liées aux conséquences de l’implantation et de l’irradiation interstitielle. Plus rarement, on peut rencontrer des syndromes de rétention urinaire et des sténoses urétrales (5 %).
De la diarrhée et des douleurs du colon peuvent se voir, dans moins de 10 % des cas.
Le taux d’impuissance variable de 0 à 25 % selon les séries publiées en raison de la très faible radioactivité des grains.
Les problèmes tardifs, vers le 4-6 ème mois, sont rares. Il peut s’agir d’un inconfort urinaire et des brûlures à la miction.
LES CONTRAINTES
Pour des raisons de sécurité (radioprotection), les médecins vous demanderont de ne pas rester en contact étroit avec une femme enceinte ou des enfants en bas âge trop longtemps les 4 premiers mois.
Les rapports sexuels doivent être protégés par l’utilisation de préservatif, pendant cette période, du fait du risque théorique de migration d’un implant dans le sperme.
Les selles, les urines, le sperme ne sont pas radioactifs.
LA SURVEILLANCE
Habituellement...
Après radiothérapie externe, le taux de PSA est habituellement contrôlé à 3 et 6 mois après la fin de la radiothérapie. Le taux doit atteindre alors son minimum. Ensuite, si tout va bien, il sera mesuré tous les 6 mois pendant 2 ans, puis annuellement.
Le rebond...
Cependant, la décroissance du PSA n’est pas régulière et peut être interrompue par des ré-ascensions transitoires. Elles surviennent chez plus d’un tiers des patients après curiethérapie de la prostate. En dépit de la nouvelle définition de la rechute biochimique intervenue en 2006, 7 à 15 % de ces rebonds miment une authentique rechute.
Le rebond est une ré-ascension bénigne du PSA, transitoire, c’est-à-dire suivie d’une reprise spontanée de la décroissance de la concentration du PSA, en dehors de toute intervention thérapeutique, pour retrouver au minimum sa valeur initiale.
La radiothérapie interne vectorisée
PSMA
L’antigène membranaire prostatique spécifique (PSMA) est une protéine membranaire prostatique. Il est présent à des niveaux élevés à la surface des cellules cancéreuses de la prostate. Il est surexprimée par le tissu prostatique tumoral, particulièrement dans les cancers de haut grade, dans les formes métastatiques et dans les formes hormono-résistantes.
C' est un biomarqueur potentiel de la maladie
LE LUTETIUM Lu177 VIPIVOTIDE TETRAXETAN
Le principe
C'est un radiothérapie interne vectorisée par ligands du PSMA marqué avec du lutétium-177 (177Lu). Elle a été évaluée chez les patients aux stades évolués de la maladie en 3ème ligne de traitement après les anti-androgènes de seconde génération et chimiothérapie par taxane.
En pratique...
Il est indiquée pour le traitement de la cancer de la prostate progressif, métastatique, résistant à la castration, surexprimant l’antigène membranaire spécifique de la prostate (PSMA) qui ont été traités par une chimiothérapie par taxane et par au moins une hormonothérapie anti-androgénique.
La posologie est de 6 administrations de 7 400 MBq chacune. L’intervalle de temps entre chaque administration est de 6 semaines (+/- 1 semaine) avec un maximum de 6 cycles en fonction de la tolérance du patient et de l’efficacité du traitement. L’intervalle de temps entre 2 administrations peut être étendu à 10 semaines en cas de toxicité.
Par mesure de précaution, les patients doivent être maintenus en isolement dans un environnement radio protégé pendant une période de 6 heures après l'administration.
La radiothérapie systémique (métabolique ou radio-pharmaceutique)
LE PRINCIPE
La radiothérapie métabolique est un traitement qui permet de cibler électivement les cellules tumorales au niveau du tissu osseux.
Il existe des agents radioactifs déjà utilisables en pratique clinique.
Les isotopes comme le phosphore-32 (P32) et le strontium-89 (Sr89) ont des demi-vies beaucoup plus longues (12 et 50 jours, respectivement) que le samarium (Sm153) et le rhénium (Re186) qui ont des demi-vies de 1,9 et 3,8 jours, respectivement. La cible des radio-isotopes est le tissu osseux péri-tumoral et non les cellules tumorales par elles-mêmes, la dose délivrée aux métastases varie en fonction de l’extension de maladie et du type d’isotope choisi.
EN PRATIQUE...
La radiothérapie métabolique par le strontium 89 (Metastron™)
C'est un médicament radio-pharmaceutique bêta émetteur.
Le strontium se comporte comme un analogue du calcium.
Une amélioration significative a été observée dans plus de 70 % des cas . L’effet sur la douleur débute vers le dixième jour après l’injection et se maintient six semaines environ.
La durée moyenne de réponse est de l'ordre de six mois. Le taux de réponse était meilleur chez les patients dont la masse métastatique osseuse était faible ou modérée. La réponse lors d’une seconde injection de 89 Sr pour reprise du syndrome douloureux est semblable à celle observée lors de la première injection, mais souvent moins rapide.
La tolérance du traitement est acceptable.
Il est homologué comme alternative à la radiothérapie externe ou en association avec celle-ci dans le traitement palliatif des douleurs liées aux métastases osseuses secondaires du cancer de la prostate chez les patients après échec de l’hormonothérapie.
La radiothérapie métabolique par le samarium-153 lexidronam pendasodique (Quadramet™)
C'est aussi un médicament radio-pharmaceutique bêta émetteur. Il est composé du samarium-153 et d’un biphopshonate qui joue le rôle de vecteur vers les zones de croissance osseuse rapide, notamment les métastases ostéoblastiques.
Le 153 Sm -EDTMP soulage les douleurs liées aux métastases osseuses à la dose maximale de 37 MBq/kg. L’effet sur la douleur est en général observé dans la semaine suivant l’administration du radiopharmaceutique et sa durée d’action est d’environ cinq mois.
Il est homologué pour le traitement antalgique des métastases osseuses ostéoblastiques douloureuses et multiples qui fixent les biphosphonates marqués au technétium (99mTc).
La radiothérapie métabolique par le rhénium : 188 Rh –HEDP
Ce radio-pharmaceutique a une demi-vie plus courte que le 89 St. Il diminue la douleur dans 60 % des cas, après une injection et, dans 92 % des cas, après la deuxième injection.
Le Radium-223 dichloride (Xofigo ™ )
C'est une substance radioactive émettant des particules α qui exercent un puissant effet antitumoral ciblé sur les métastases osseuses. La faible proportion de rayonnement alpha et bêta émise n’entraîne pas de mesures de radioprotection spécifiques pour les patients.
Ce médicament a un métabolisme analogue à celui du calcium et se fixe au niveau osseux, principalement dans les zones d’activation ostéoblastiques.
Les résultats des études ont démontré l’efficacité du traitement efficace et sa bonne tolérance pour les cancers de la prostate résistant à la castration, symptomatiques, avec métastases osseuses.
Ce qu'il faut retenir...
- Le risque de rechute locale dans la prostate après radiothérapie est faible.
- La majorité des rechutes biochimiques qui surviennent après la radiothérapie, sont en lien avec des rechutes à distance.
- Un cancer localisé ne devrait plus être traité avec hormonothérapie seule.
Mise à jour
3 septembre 2022

