Les tumeurs malignes
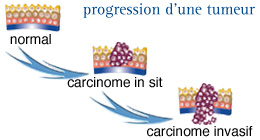
Le cancer au stade non invasif
Le terme in situ désigne un stade précoce de cancer lorsqu'il est encore confiné à la zone immédiate où il a commencé.
Pour les cancers colorectaux, In situ, signifie que le cancer reste confiné au tissu de surface (épithélium) du côlon. A ce stade, le cancer n’a pas envahi les tissus adjacents de la paroi du côlon ou du rectum et il ne s’est pas étendu aux autres organes.
Le carcinome in situ est donc un stade d’évolution intermédiaire entre l’hyperplasie atypique des cellules du côlon qui est encore bénigne et le cancer invasif qui comporte un risque d’extension en dehors du côlon ou du rectum.
UN CANCER EST DÉCOUVERT, QUAND A-T- IL COMMENCÉ ?
- 5 à 10 ans entre les premières cellules cancéreuses et la découverte d'une tumeur de 0,5 et 1,5 cm
- Temps de doublement de taille d’une tumeur maligne : 3 mois
- 1 g de tumeur = un milliard de cellules
Quelle est l’évolution des cancers invasifs ?
L'EXTENSION LOCALE
Le cancer s’étend circonférenciellement pour réaliser à l’extrême une forme sténosante dont la complication clinique est l’occlusion intestinale.
Depuis la surface, le cancer infiltre progressivement les différentes tuniques de la paroi digestive puis la séreuse, sauf au niveau du rectum où il n’y en a pas.
Non traité, il envahit ensuite les tissus avoisinants et les organes adjacents. Cette extension suit la direction d’un rayon, d'où le terme d'extension radiaire.
Dans la paroi digestive, l’extension microscopique déborde rarement de plus de 1 cm la tumeur macroscopique en amont et en aval. A l’extérieur de la paroi digestive, elle peut dépasser 2 cm en aval et plus, surtout en cas de cancer peu différencié.
L'ATTEINTE DES GANGLIONS (N)
Elle est ordonnée et intéresse d’abord les ganglions épi- et para- coliques, avant la propagation aux groupes intermédiaires. Dans moins de 3 % des cas, les cellules sautent un relai ganglionnaire.
Le risque d’extension ganglionnaire augmente avec le degré d’infiltration tumorale en profondeur et avec le grade tumoral.
LES MÉTASTASES
Selon des études récentes la progression métastatique du cancer colorectal peut se faire de manière séquentielle à partir des métastases ganglionnaires mais aussi, de façon parallèle, avec un essaimage à partir de plusieurs clones de la tumeur primitive, d’une part au niveau des ganglions, et d’autre part directement vers les autres organes.
Les tumeurs coliques ou rectales peuvent métastaser au péritoine lorsqu’elles ont franchi la séreuse péritonéale, soit de façon contiguë, soit de façon non contiguë, à distance dans la grande cavité abdominale.
L’envahissement veineux représente une des voies de propagation et d’essaimage à proximité, et à distance vers la veine porte et le foie. L’extension métastatique se fait surtout par voie portale. Les localisations des métastases de la maladie sont :
- Hépatiques, dans 75 % des cas
- Pulmonaires dans 15 %, dans ce cas, les cellules tumorales atteignent les poumons en empruntant les veines iliaques puis la veine cave inférieure, dans le cas du cancer du rectum, ou après avoir franchi le filtre hépatique
- Plus rarement, osseuses ou cérébrales, dans 5 % des cas.
L’augmentation de l’incidence de métastases cérébrales secondaires est liée à un allongement de la survie globale depuis l’introduction de l’oxaliplatine, de l’irinotécan et de thérapies ciblées. Cette incidence reste néanmoins faible de l’ordre de 2 à 3 %. Les métastases cérébrales surviennent généralement à un stade tardif, multimétastatique.
LES RÉCIDIVES EVENTUELLES DE LA MALADIE
Le cancer colorectal, une fois traité, peut parfois récidiver au même endroit ou près du site initial de la tumeur. La rechute locale peut survenir sur l’emplacement même de l’anastomose qui est l’endroit où les deux sections du côlon sont ressoudées après la chirurgie d’exérèse du cancer.
Cet événement est peu fréquent. Les rechutes locales sont un peu plus fréquentes dans les cancers rectaux que dans les cancers du côlon.
Le cancer colorectal peut aussi rechuter sur un site à distance de la tumeur initiale. Dans ce cas cela s’appelle une métastase. Le foie et les poumons sont des sites fréquents de métastases du cancer colorectal.
Le processus de cancérisation
GLOBALEMENT
Les deux voies principales de la cancérogenèse colorectale : l’instabilité chromosomique (CIN) dans 70 à 90 % des cas ou l'instabilité génétique (MSI) dans 10 à 15 % des cas
DES MUTATIONS GÉNÉTIQUES
Le séquencement du génome des cancers humains à permis de d'identifier des mutations affectant 848 gènes, à partir desquels 140 contribuent au développement de la maladie (phénotype "cancer"). Par exemple, les cellules d'un cancer colorectal présentent au moins 15 gènes mutés. A ces 15 gènes mutés, ont peut ajouter 61 autres gènes qui apparaissent parfois.
UNE RÉPARATION DÉFAILLANTE DE L'ADN
MMR (MisMatch Repair)
Lors de la réplication de l’ADN nécessaire à la division cellulaire, des mésappariements peuvent survenir, T=G au lieu de T=A par exemple.
Un complexe de protéines est alors nécessaire pour réparer ces mésappariements incluant, entre autre, les protéines MLH1, PMS2, MSH2 et MSH6. Ce système de réparation de l'ADN est dénommé système MMR (MisMatch Repair).
Lorsque l’une des protéines du complexe NMR est non fonctionnelle, le système de réparation des mésappariements est dit déficient (dMMR).
La déficience du système MMR n’est pas un mécanisme oncogénique en soi. Cependant, elle peut être initiatrice de différents types de cancers par accumulation d’erreurs dans des séquences d’ADN activatrice d’oncogènes ou inhibitrices de gènes suppresseurs de tumeurs.
MSI (MicroSatellite Instability)
Lorsque le système MMR est déficient, les erreurs survenues au cours de la réplication de l’ADN s’accumulent particulièrement dans ces régions microsatellitaires, ce qui aboutit à une instabilité des microsatellites (MSI).
La conséquence est une accumulation de mutations surtout au niveau des séquences d'ADN courtes répétitives, non-codantes, appelées microsatellites.
Les séquences micro-satellitaires sont des régions de répétitions nucléotidiques (CACACACA…; TGTGTG…) situées en amont des régions codantes des gènes. Ces répétitions débouchent sur une instabilité microsatellitaire.
Ces mutations affectant le gène MMR (MisMatch Repair) et les gènes hMSH2, hMLH1 et hMSH6 aboutissent à une incapacité du système de réparation de l'ADN à corriger les erreurs de réplications de l'ADN. Un phénotype MSI se retrouve dans deux types principaux de situations :
- Lors d'une mutation constitutionnelle / germinale d’une des protéines du système MMR (MLH1 et MSH2>>MSH6>>>PMS2) ou du gène Epcam (gène situé en amont du promoteur du gène MSH2) qui se rencontre dans le syndrome de Lynch/HNPCC.
- Lors d'une altération épigénétique, le plus souvent par hyper-méthylation du promoteur du gène MLH1 (MSI sporadique)
Les tumeurs ayant un phénotype associé à une déficience du MMR sont appelées tumeurs à forte instabilité microsatellitaire (MSI-H) et sont retrouvées chez environ 15 % des patients présentant un cancer colorectal sporadique.
INSTABILITÉ GÉNÉTIQUE DES CELLULES DU CÔLON
La perte de la stabilité génomique est un facteur important dans la promotion de l'oncogenèse. Elle a deux origines possibles, non exclusives
Une instabilité chromosomique (CIN) s'amplifiant au cours de mutations successives :
- Des mutations affectant le gène APC
- Une méthylation du gène promoteur MGMT
- Des mutations du gène KRAS
- Des mutations, affectant le gardien du génome, le p53
Une instabilité microsatellitaire (MSI) due à une anomalie des gènes responsables de réparation de l'ADN, MMR (mimatch-repair), qui se traduit par une incapacité à réparer les erreurs lors de la réplication de la molécule d'ADN. Cette instabilité microsatellitaire peut être, elle même, la conséquence :
- D'une anomalie héréditaire portant sur les gènes MLH1 , MSH2 ou MSH6
- D'une mutation acquise de la méthylation, portant sur le gène MLH1
- Des mutations affectant le BRAF
- D'une anomalie acquise et un phénotype aboutissant à une méthylation des ilots CpG de la molécule d'ADN.
LA RECHERCHE TRANSLATIONNELLE
L’analyse de l’ADN tissulaire prélevé à différentes étapes de la cancérogenèse colique a permis de suivre les mutations contribuant à l’émergence d’un clone cellulaire tumoral capable de prolifération et d’invasion des tissus voisins.
L’instabilité microsatellitaire (MSI) est caractérisée par une forte charge mutationnelle et par conséquent, une forte réponse immune. Cette situation serait très favorable à une sensibilité à une immunothérapie par des médicaments inhibiteurs du checkpoint immunitaire.
| Syndrome de Lynch 2 à 5% des CCR |
Cancer MSI sporadique 15% des CCR |
|---|---|
|
Mutation germinale d’un gène MMR ou du gène Epcam |
Inactivation somatique d’un gène MMR |
La conception actuelle des étapes de la cancérisation
- Echappement au système immunitaire par l'effet immunosuppressif des cytokines locales
- Evasion des facteurs inhibant la croissance cellulaire : mutation et inhibition des facteurs inhibant la croissance cellulaire et/ou de leurs récepteurs cellulaires
- Instabilité génomique et mutations : inactivation des système de réparation de l'ADN
- Mise en route des systèmes cellulaire aboutissant à "l'immortalité cellulaire" : inhibition des mécanismes induisant la sénescence cellulaire et induction de l'activité des télomérases.
- Dérégulation des systèmes cellulaires énergétiques : glycolyse aérobique et glutaminolyse
- Inflammation induite par la tumeur : induction des facteurs de croissance induisant l'angiogenèse par les cellules locales de l'inflammation
- Induction de l'angiogenèse : formation de néovaisseaux
- Inhibition des mécanismes aboutissant à la mort cellulaire : échappement aux médiateurs locaux induisant l'apoptose, la nécrose ou la nécroptose
- Activation des mécanisme permettant l'invasion locale et les métastases à distance : remodelling de la matrice extra-cellulaire permettant la migration cellulaire et l'induction de la transition épithéliale–mésenchymale
@ Hanahan D, Weinberg RA. The hallmarks of cancer. Cell. 2000;100:57–70. Hallmarks of cancer: the next generation. Cell. 2011;144:646–74.
De l'épithélium normal à l'adénome et au cancer...
La carcinogenèse du cancer colorectal est un processus en étapes successives. Ces étapes impliquent des mutations de certains gènes suppresseurs de tumeur comme les gènes APC , DCC et p53 et l'expression d’oncogènes, comme le K-ras. Chacune de ces étapes donne naissance à une population cellulaire dont la croissance est de plus en plus anarchique.
Epithélium colique normal - Mutation de l'anti-oncogène APC
⇓
Adénome débutant (petit polype) - Mutation de l'oncogène K-ras
⇓
Adénome (gros polype) - Mutation de l'anti-oncogène p53
⇓
Adénocarcinome
@ Pour en savoir plus : LES ÉTAPES DE LA CANCÉRISATION
DEUX MALADIES DIFFÉRENTES ?
LE CANCER DU CÔLON GAUCHE
Ses caractéristiques
L’incidence du cancer du colon gauche est supérieure à celle du cancer colique droit. De plus, la moitié des cancers coliques gauche sont localisés au sigmoïde. Ces cancers se caractérisent par une prédominance masculine qui apparaît au-delà de 65 ans. Ils sont, en moyenne de meilleur pronostic que les cancer affectant le côlon droit.
Sa génomique
L’étude des altérations génétiques montre que dans plus des trois quarts des cas, elles correspondent au groupe des tumeurs LOH+ (Loss Of Heterozygosity) .
Les anomalies génétiques se caractérisent par des pertes alléliques notamment sur le bras court du chromosome 17 et le bras long du chromosome 18, associé à une hyperploïdie.
LE CANCER DU CÔLON DROIT
Ses caractéristiques
Le sexe ratio des cancers du cæcum, du côlon droit et du côlon transverse est voisin de 1 dans tous les groupes d’âge. En revanche, le cancer du côlon droit prédomine chez la femme entre 70 et 80 ans.
L’augmentation d’incidence avec l’âge est plus marquée pour les cancers du côlon droit que pour les cancers du côlon gauche. Il est plus fréquent en cas de syndrome de Lynch (cancer familial non polyposique).
Sa génomique
Les anomalies génétiques sont plus rares, seulement dans moins de la moitié des cas.
Un tiers des cancers du côlon droit présentent un taux élevé d’erreurs de réplication des loci microsatellitaires (MSI, CIMP élevés) ; c’est le groupe des cancers RER+ avec instabilité microsatellite. De plus, ils présentent souvent une mutation du BRAF (gène normal de la cellule B-Raf - proto-oncogène). Ce type d’altérations est pratiquement absent dans le côlon gauche.
LE CANCER DU RECTUM
Il est diagnostiqué chez des patients moins âgés. Il existe, en outre, une incidence plus élevée chez les sujets d'origine asiatiques.
Mise à jour
26 mars 2023

