Les tumeurs malignes
Les lésions précancéreuses
Les cancers invasifs
BRONCHIQUE OU PULMONAIRE ?
Le terme de cancer du poumon est, en fait, souvent peu approprié car, fréquemment, il se développe à partir des cellules tapissant les bronches. Ce serait, donc, plutôt un cancer bronchique. De fait, le terme le plus exact serait donc le cancer broncho-pulmonaire.
DES CELLULES SANS CONTRÔLE...
Un processus commun à tous les cancers
Le tissu d'un poumon normal est constitué de cellules qui sont programmées par des gènes. La croissance des cellules est harmonieuse, les cellules nouvelles remplaçant les cellules mortes. Le cancer du poumon se développe lorsque la croissance des cellules se dérègle.
L'évolution de la tumeur se fait par plusieurs étapes et implique une série de mutations entrainant l’activation d’oncogènes (gènes dominants, dont la mutation est activatrice) et/ou l’inactivation de gènes suppresseurs de tumeurs (gènes récessifs dont la perte des 2 allèles est inactivatrice).
Des mutations affectant le génome
Ceci apparaît lorsque le matériel génétique responsable de la production des cellules du poumon est endommagé par une série de mutations génétiques. Les recherches du Cancer Genome Project (CGP) ont abouti à la caractérisation de plusieurs types d'anomalies :
- Plusieurs gènes suppresseurs de tumeur sont inactivés comme le TP53, dans plus de 80 % des cas, le RB1 chez plus de 70 % des malades et plus rarement le PTEN dans environ 15 % des cas
- Dans moins de 10 % des cas, des mutations aboutissent à l'activation d'oncogènes, comme le PIK3CA , le récepteur du facteur épidermique de croissance ou le KRAS.
L'INITIATION, PREMIERE ETAPE SILENCIEUSE
L’accumulation successive d’altérations géniques, étalées sur des dizaines d’années, sous l’effet des carcinogènes, en particulier ceux contenus dans la fumée de tabac vont transformer les cellules qui acquièrent, alors, un phénotype invasif.
On estime actuellement qu’il existe schématiquement un déséquilibre entre l’activation excessive des oncogènes comme K-RAS ou les récepteurs à activité tyrosine kinase des facteurs de croissance et l’inactivation d’anti-oncogènes comme le gène TP53 ou la dérégulation des propriétés apoptotiques.
LA PROMOTION…
A partir de ce moment là, d’autres mutations vont modifier des propriétés essentielles de la cellule, en particulier celles affectant les gènes codant pour des régulateurs de l’apoptose (mort cellulaire programmée), tels que le RasSF1, le principal gène suppresseur du chromosome 3p et le gène de la DAP kinase. C’est à ce moment que la maladie va pouvoir se disséminer.
LA DISSÉMINATION…
De plus, des gènes codant pour des protéines de l’adhésion et de la motilité cellulaires peuvent être altérés. L’altération des molécules permettant l’adhésion des cellules entre elles, favorise alors la migration des cellules tumorales et donc les processus métastatique.
Ces addictions oncogéniques sont principalement détectées en cas d'adénocarcinome et chez les non-fumeurs (jamais fumeurs ou fumeurs sevrés depuis plus de 10 ans).
Ces mutations sont prédictives de la réponse aux inhibiteurs de tyrosine kinase (ITK).
@ Pour en savoir plus, allez à : LES CAUSES DU CANCER
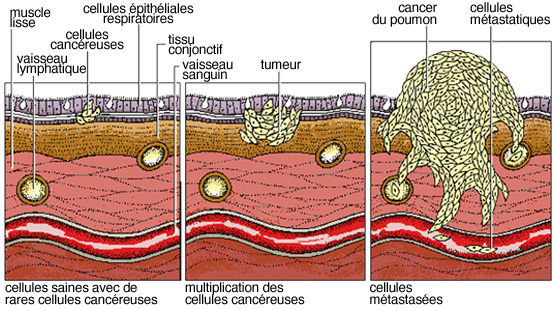
UN CANCER EST DÉCOUVERT, QUAND A-T- IL COMMENCÉ ?
5 à 10 ans entre l'émergence des premières cellules cancéreuses et une tumeur de 1,5 cm
Temps de doublement de taille d’une tumeur maligne du poumon ~ 3 mois
1 g de tumeur contient 109 cellules
1 kg de tumeur contient 1012 cellules et n’est plus compatible avec la vie
Quelques données à propos de la cinétique tumorale
|
Cancer du poumon |
Survie à 5 ans sans métastase |
Survie à 5 ans avec métastase(s) (%) |
Rechutes tardives à 5 et 10 ans (%) |
Temps de doublement de la tumeur primitive en jours |
Doublement de volume jusqu’au diagnostic |
Temps de passage à T1 lors du diagnostic (années) |
|---|---|---|---|---|---|---|
|
Non à petites cellules |
|
4 |
8–11 |
– |
35 |
– |
|
Adénocarcinome |
75–80 |
|
– |
185–215 |
– |
18–20 |
|
A petites cellules |
20–30 |
|
– |
90–144 |
– |
9–14 |
L'évolution de la maladie
L'ATTEINTE DES GANGLIONS
La dissémination de la maladie aux ganglions lymphatiques
Elle signifie que certaines cellules cancéreuses ont eu la capacité de sortir du poumon pour former d'autres colonies tumorales. Il existe donc un risque que d'autres cellules cancéreuses aient suivi le même processus pour aller dans d'autres organes du corps.
C'est pourquoi il est important de déterminer si le cancer du poumon s'est étendu aux ganglions lymphatiques afin de permettre d'adapter la stratégie thérapeutique à cette situation.
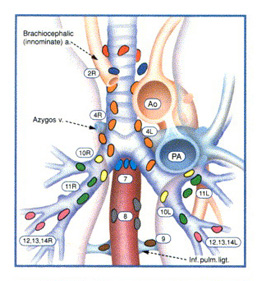
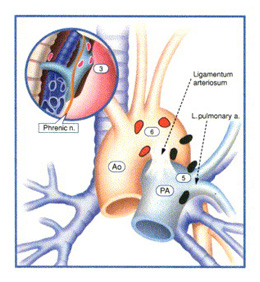
Les ganglions concernés
Ils se retrouvent sur le chemin des vaisseaux lymphatiques drainant le poumon. Ils se regroupent au niveau de trois groupes de ganglions, autour des bronches (non palpables), dans le médiastin (non palpables mais visibles à la radio) et, plus rarement, dans le creux sus claviculaire où ils peuvent être palpés.
LES MÉTASTASES
Elles sont la conséquence de la migration de cellules tumorales, devenues mobiles, en dehors du poumon. La dissémination se fait, soit par les vaisseaux lymphatiques, soit par les vaisseaux sanguins.
Les organes le plus fréquemment touchés sont les os, le foie, le cerveau, les autres parties des poumons et les glandes surrénales.
Les cas des métastases cérébrales
ELLES SONT FREQUENTES..
Le cancer du poumon est la première cause de métastases cérébrales
Il est ainsi à l’origine de 40 à 50 % de toutes les métastases cérébrales. Ceci explique que le scanner cérébral après injection ou l’IRM cérébrale est systématique dans le bilan d’extension initial des cancers bronchiques à petites cellules et dans celui des carcinomes non épidermoïdes du fait de la fréquence des métastases asymptomatiques.
Parfois présentes au moment du diagnostic...
En cas de carcinome bronchique à petites cellules, dans 10 à 15 % des cas, des métastases cérébrales existent au moment du diagnostic. Ainsi, la moitié des patients qui ne reçoivent pas d’irradiation prophylactique cérébrale verront se développer des métastases cérébrales, généralement dans les 2 ans.
En cas de carcinome bronchique non à petites cellules, dans 10 à 18 % des cas, des métastases cérébrales sont aussi détectées au moment du diagnostic. La prévalence varie de 13 à 30 % au cours de l’évolution de la maladie suivant les études.
Pour les formes localisées, 9 à 37 % des rechutes après exérèse chirurgicale surviennent dans le cerveau
Pour les formes localement évoluées de stade III, les métastases cérébrales représentent le premier site de rechute tumorale dans 23 % des cas.
En définitive, 50 % des patients présenteront des métastases cérébrales à un moment de la maladie.
FACTEURS FAVORISANTS
Les carcinomes bronchiques à petites cellules sont plus à risque de métastases cérébrales que les adénocarcinomes et les carcinomes épidermoïdes. Le risque est également lié au stade TNM, avec un risque d’autant plus élevé que la maladie est étendue.
L’influence des récepteurs de l’epidermal growth factor (EGFR) sur une éventuelle augmentation de l’incidence de survenue de métastases cérébrales n’est pas clairement établie à ce jour.
LE RISQUE
Dans les carcinomes bronchiques à petites cellules, s'ils sont en rémission complète, le risque cumulé de métastases cérébrales à 3 ans est de près de 60 %.
Dans les carcinomes bronchiques non à petites cellules, au stade III, traités, le risque de survenue de métastases cérébrales à 1 an est de 18 %. Dans les formes au stade IV, 30 à 40 % des métastases cérébrales sont synchrones (en même temps). En revanche, le délai médian d’apparition de métastases cérébrales métachrones (décalées dans le temps) est d’environ 14 mois.
PRONOSTIC
Les facteurs de pronostic défavorables à partir du moment du diagnostic de métastases cérébrales incluent :
- L'absence de contrôle de la tumeur primitive
- Le sexe masculin
- Un mauvais état général reflété par un indice de performance (PS) 2 ou plus
- Un âge supérieur à 63 ans
- Le taux de sodium dans le sang (ionogramme) <132 mmol/L
- Un taux de NSE (neuron specific enolase) > 12,5 ng
- Le carcinome bronchique à petites cellules
En l’absence de traitement, la durée médiane de survie des patients varie de 3 à 4 mois lorsqu’il s’agit d’un carcinome à petites cellules, de 4 à 16 mois pour les autres formes, avec dans ce dernier cas des durées de survie de 5 à 18 mois s’il y a une mutation du gènes codant pour l’EGFR ou avec un réarrangement du gène ALK (anaplastic lymphoma kinase).
Mise à jour
23 novembre 2021

