Constitutionnels
On n’hérite pas d’un cancer mais d’une prédisposition à développer un cancer...
UN RETOUR EN ARRIÈRE...
Les premiers cas de cancers du sein "héréditaires" furent décrits au XIXème siècle par un médecin français, P. Broca* dans son "Traité des Tumeurs - Paris, 1866", dans lequel il rapportait le cas de son épouse qui développa, jeune, un cancer du sein et, dans sa généalogie, quatre générations successives avaient présenté un cancer du sein...
POURQUOI ?
Le cancer est une maladie dont le point de départ est, selon toute vraisemblance, une altération de l'ADN qui est le composant essentiel des gènes. Les altérations de l’ADN peuvent être :
- Congénitales, c’est à dire transmises à la naissance par l'hérédité
- Acquises, le plus fréquemment, c’est à dire apparaître après la naissance et sont le résultat d'une erreur dans la reproduction des cellules, favorisée, souvent, par l'exposition à des substances cancérogènes, c'est-à-dire des substances causant l'apparition d'un cancer.
@ * Paul Pierre Broca (1824 - 1880) médecin, anatomiste et anthropologue français
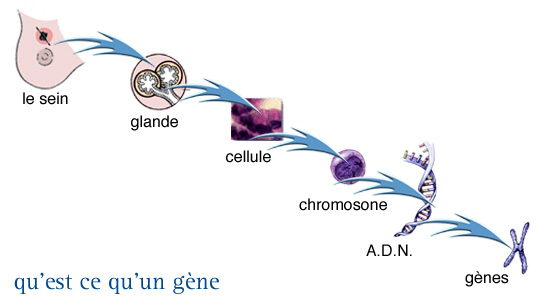
Les cancers génétiques vrais ou cancers héréditaires ou familiaux
CE N'EST PAS FRÉQUENT...
Lorsque plusieurs personnes d’une même fratrie sont atteintes du même cancer, il s’agit, vraisemblablement, d’un cancer héréditaire dû à une anomalie génétique (mutation) qui se transmet d’une génération à une autre.
On estime qu'environ 5 à 10 % des cancers du sein ont une prédisposition génétique ou une histoire familiale. Dans la majorité des cas, cette prédisposition est liée à la présence d’une mutation constitutionnelle des gènes BRCA1 et BRCA2.
En France, cela représente environ 2 000 nouveaux cas de cancers du sein et 200 cancers de l’ovaire.
LES MUTATIONS GENETIQUES OBSERVÉES
Des études récentes ont montré que la plupart de ces cancers sont dus à des mutations héréditaires de certains gènes.
- BRCA1 porté par le chromosome13q12-13, dans 20 à 40 % des cas
- BRCA2 porté par le chromosome 17q12-21, dans 10 à 30 % des cas
- Tp53 (chromosome 17p12-21), PTEN (chromosome 17q23), ATM (chromosome 11q21), CHK2 ou STK11 (chromosome 17q12-21) dans 5 % des cas
- D'autres gènes comme le RAD51 ou le PALB2
LES CONSÉQUENCES...
La présence du mutation des gènes BRCA1 et/ou BRCA2 chez une femme accroît le risque de développer :
- Un cancer du sein à un âge précoce ;
- Un cancer sur le sein controlatéral après diagnostic d’un premier cancer ;
- Un cancer de l’ovaire, essentiellement après 40 ans, le risque variant dans ce cas selon le gène touché et l’histoire familiale associée.
Si ces mutations sont découvertes à l'occasion, par exemple, d'une consultation d'oncogénétique , leur connaissance implique un certain nombre de mesures bien codifiées, comme, une stratégie de dépistage adaptée au niveau de risque, des modalités thérapeutiques particulières, dans certains cas une chimio-prévention et un dépistage chez les patients à risque.
Les formes génétiques de cancer du sein...
Un mode de transmission autosomique dominant avec une pénétrance incomplète
Deux gènes majeurs : BRCA1 et BRCA2
2 000 à 3 000 nouveaux cas/an ; 50 000 femmes prédisposées ; responsables de 1 000 décès en France
Gènes évalués en cas de suspicion de prédisposition aux cancers du sein et/ou de l’ovaire
|
Gènes associés à un risque élevé de |
Gènes associés à un risque élevé de |
|---|---|
|
BRCA1, BRCA2 |
BRCA1, BRCA2 |
Les gènes BRCA1 et BRCA2
DES GENES ASSURANT LA STABILITÉ DU GÉNOME ...
En dépit de multiples attaques de la part de l’environnement, le génome de la cellule, c’est-à-dire, son ADN, est très stable car on estime qu'il est le lieu de milliers de lésions, ce qui implique des mécanismes de réparation très efficaces.
La stabilité du génome est assurée par des protéines synthétisées par les gènes de réparation de l’ADN, dont font partie le BRCA1 (BReast CAncer).
Il y a 30 ans, Mary-Claire King publiait dans Science (1990;250:1684–89). la localisation sur le bras long du chromosome 17 d'un premier gène de prédisposition aux cancers du sein.
Isolé en 1995, le gène BRCA2 est situé sur le chromosome 13q12-13 et n’a aucune homologie avec le gène BRCA1.
es protéines codées par ces gènes sont aussi impliquées dans les voies de réparation de l’ADN, principalement la voie de la recombinaison homologue.
Les gènes BRCA1 et BRCA2 du fait de leurs fonctions mixtes répondent à la fois à la définition de gènes :
- Gardiens du génome (ou caretakers) - intervenant dans le maintien de son intégrité par la réparation des lésions double brin de l’ADN
- Suppresseurs de tumeurs. La majorité des mutations constitutionnelles qui les touchent sont de type « perte de fonction », de transmission autosomique dominante.
Les altérations constitutionnelles des gènes BRCA1/2 sont transmises de façon autosomale dominante. Il y a donc un risque sur deux qu’un parent transmette la mutation à son descendant.
CE SONT DES GÈNES SUPPRESSEURS DE TUMEUR
Ils agissent comme des gardiens du génome...
La mutation ou la déficience de ces gènes, ainsi que de l’ATM, associé au BRCA1, peut aboutir à la non-réparation de l’ADN lésé, entraînant une mutation de la cellule qui peut, par la suite, évoluer vers un phénotype cancéreux.
Il existe un très grand nombre de mutations constitutionnelles des gènes BRCA1 et BRCA2 . Ces mutations sont dites inactivatrices, c’est-à-dire qu’elles empêchent le bon fonctionnement du gène.
Un rôle physiologique important...
Une des fonctions essentielles du BRCA1 , durant la puberté et la grossesse, pourrait être de protéger le sein contre l’instabilité génétique secondaire à la prolifération des cellules de la glande mammaire induite la sécrétion des œstrogènes. Ce gène permettrait la réparation des cassures de l’ADN. Ceci expliquerait que, dans la plupart des cancers héréditaires, le développement de la maladie ne serait pas dû à la succession des événements hormonaux de la vie, comme la puberté, les cycles menstruels, les grossesses mais, plutôt, à une puberté précoce associée à une sensibilité anormale du sein aux œstrogènes.
L'étude "Breast Cancer Association Consortium* retrouve d'autres mutations plus rares...
Une mutation du gène PALB2 (Partner and localizer of BRCA2) serait associée à une augmentation faible du risque de développer la maladie. Elle serait à l’origine d’environ 1 % des cancers du sein héréditaires, contre 5 à 10 % pour les mutations BRCA1 et/ou BCRA2, particulièrement chez les femmes de moins de 40 ans.
Une mutation des gènes BARD1, RAD51C, et RAD51D serait associée à une augmentation du risque de cancer du sein sans récepteur estrogène (ER-) et d'une forme dite "triple négative"
Une mutation des gènes ATM, CDH1, et CHEK2, à l'opposé, serait associée à une augmentation du risque de développer une forme ER+ de cancer du sein
@ https://www.nejm.org/doi/full/10.1056/NEJMoa1913948?query=TOC
Quelque chiffres
UN ORDRE DE GRANDEUR...
Dans la population générale
Près de 1 sur 300 et 1 sur 800 individus sont porteurs de mutations des gènes BRCA1 et BRCA2, respectivement. De fait, le risque est variable selon les ethnies. Par exemple, elle est de 1 sur 40 chez les ashkénazes, 1 sur 170 chez les islandais et 1 sur 133 chez les hollandais.
En France
La fréquence des personnes porteuses d’une mutation de BRCA1 et BRCA2 est estimée à environ 2 femmes sur 1 000. Comme il y a en France environ 20 millions de femmes âgées de 20 à 70 ans, 40 000 environ sont porteuses de mutations et donc à haut risque de développer la maladie. On peut donc estimer que le nombre de cas incidents, chaque année est de 1 pour 420 femmes (intervalle de confiance de 188 à 925), soit 596.
LE RISQUE...
Les mutations du gène BRCA1
Elles augmentent le risque de développer la maladie. Il est multiplié par 7.6 si l'on prend une population générale de femmes.
Le risque cumulé de cancer du sein à 80 ans pour une mutation BRCA1 est de 67 %, pour le cancer du sein et 45 % pour le cancer de l'ovaire. Pour ce dernier, l'apparition de la maladie est précoce et il est, le plus souvent de type séreux..
Les trois quarts de ces cancers n'expriment, en général, pas de récepteurs hormonaux et la plupart sont qualifiés de "triple négatifs", c'est-a-dire qu'ils n'expriment ni les récepteurs hormonaux (ER et PR) ni le facteur de croissance HER2.
Les mutations du gène BRCA2
Elles augmentent le risque de développer la maladie. Il est multiplié 5.2 dans le cas d'une mutation BRCA2, si l'on prend une population générale de femmes.
Le risque cumulé de cancer du sein à 80 ans pour une mutation BRCA2 est de 66 %, pour le cancer du sein et 12 % pour le cancer de l'ovaire.
Les trois quarts de ces cancers expriment les récepteurs hormonaux et seulement 16 % sont qualifiés de " triple négatifs ".
Après un premier cancer, en cas de mutation, il y a une augmentation du risque de développer un cancer dans l'autre sein.
Mutations génétiques & associations
|
Mutation BRCA1 |
Mutation BRCA2 (chromosome 13 - 13q12-13) corrélée à |
Mutation BRCA3 (chromosome 8) associée à |
|---|---|---|
|
|
|
Le gène PALB2
SON ROLE
Le gène PALB2, localisé sur le bras court du chromosome 16 (16p12.2), code une protéine de 1186 acides aminés, PALB2 et implique, sur la molécule d'ADN, 38Mbases.
L’extrémité amino-terminale de la protéine PLAB2 possède une super hélice permettant l’interaction avec les protéines BRCA1 et RAD51, tandis que son extrémité carboxy-terminale présente un domaine permettant l’interaction avec la protéine BRCA2 et des polymérases.
De par sa position, PALB2 occupe une place centrale dans le système de réparation des cassures double brin de l’ADN.
REPARER L'ADN
Les cassures double brin provoquées par le stress oxydant ou les radiations, par exemple, sont reconnues par le complexe de réparation de l'ADN, MRN (MRE11, RAD50 et NBS1).
Ce complexe MRN active une enzyme la kinase, ATM (Ataxia Telangiectasia Mutated*) dont la fonction est de réparer les cassures double-brins dans l’ADN occasionnées par des agressions physiques ou des processus physiologiques.
Une autre kinase, ATR (ataxia-telangiectasia-like and Rad3 homolog), essentielle à la survie cellulaire, est quant à elle activée par TopBP1 (Topoisomerase 2 – binding protein 1). Ces deux kinases jouent un rôle essentiel puisqu’elles recrutent les différentes protéines nécessaires à la recombinaison homologue de l'ADN.
Le complexe MRN, puis les exonucléases, permettent ensuite de couper les brins d'ADN défectueux.
La protéine BRCA1 vient alors se fixer au niveau de la lésion, et recrute à son tour la protéine PALB2. La protéine PALB2, une fois positionnée interagit avec les protéines BRCA2 et RAD51, ainsi qu’avec les polymérases. Cela permet la progression de la recombinaison homologue et la réparation de l'ADN.
SON IMPLICATION
Les faits
Le risque de développer un cancer du sein chez des patientes porteuses d’une mutation constitutionnelle mono-allelique de PALB2 est supérieur à celui de la population générale. Initialement considéré comme un gène de susceptibilité modérée dans la survenue des cancers du sein, les dernières études le placent au même titre que BRCA1 et BRCA2, comme un gène à risque très élevé.
Sa détermination
PALB2 doit être considéré comme un gène de susceptibilité élevée dans le développement du cancer ovarien, du cancer du sein, en particulier du cancer triple négatif.
Depuis 2017, le gène PALB2 fait partie des gènes devant être étudiés face à un risque héréditaire du cancer du sein.
La surveillance mammaire chez une patiente mutée PALB2 doit, maintenant, comporter, en plus de l’examen clinique, une IRM couplée à une mammographie et éventuellement une échographie de manière annuelle, de 30 à 65 ans.
* Protéine mutée dans le syndrome d'ataxie télangiectasie
Mutations BRCA1/BRCA2 & risque de développer un cancer
| Mutations BRCA1 ou BRCA2 & risque de cancer du sein et de l'ovaire |
|---|
|
@ SOURCE : Lynn C. NEJM 2016;374:454-468
Indications reconnues pour un test génétique
|
Critères individuels |
Critères familiaux |
|
|
Le maître mot est : dépistage...
Si vous appartenez à cette population à haut risque, les différentes sociétés savantes recommandent dès 35 ans ou 5 ans plus tôt que l’âge de découverte d’un cancer du sein dans la fratrie : un examen clinique des seins tous les 6 à 12 mois et une mammographie annuelle avec échographie si les seins sont denses, ou plutôt une IRM
Il faut souligner que le pronostic des cancers avec mutation du BRCA n’est pas significativement différent de celui des cancers du sein sporadiques.
Une forme familiale de cancer du sein est possible en cas de...
- 3 sujets atteints de cancer du sein dont au moins un cas avant l’âge de 60 ans chez des apparentées
- de premier ou second degré.
- 2 cas de cancer du sein chez des apparentés du premier degré (ou du deuxième degré), si l’un d’eux
- est diagnostiqué avant 45-50 ans ou d’une forme bilatérale (si premier cancer diagnostiqué avant 51
- ans).
- Cancer du sein et cancer de l’ovaire chez des apparentés du premier degré ou deuxième degré si la
- transmission est paternelle.
- Cancer de l’ovaire (hors tumeurs borderline et germinales) avant 76 ans ou séreux de haut grade
- quel que soit l’âge et statut BRCA tumoral inconnu ou analyse tumorale infaisable.
- Cancer du sein avant 41 ans.
- Cancer du sein triple négatif avant 51 ans.
- Cancer du sein bilatéral si le premier est diagnostiqué avant 51 ans.
- Cancer du sein chez l’homme quel que soit l’âge.
- Situations évocatrices de formes syndromiques : maladie de Cowden (PTEN), syndrome de Li-
- Fraumeni (TP53), association cancer gastrique diffus et carcinome lobulaire infiltrant du sein (CDH1).
- Toute autre famille à caractère particulier, tumeurs primitives multiples.
- Identification d’une altération tumorale de BRCA1 ou BRCA2 (ovaire, sein ou autre localisation)
Risque cumulé de développer un cancer du sein s'il y a des cas dans la famille
| Risque cumulé à 80 ans | Cancer du sein avant 50 ans | Cancer du sein après 50 ans |
|---|---|---|
| Une parente 1er degré | 13 à 21% | 9 à 11 % |
| Deux parentes 1er degré | 35 à 48 % | 11 à 24 % |
| Une parente 2ème degré | 10 à 14% | 8 à 9% |
| Deux parentes 2ème degré | 21 à 26% | 9 à 16 % |
Vos questions légitimes et les réponses que l'on peut apporter ...
Il y a des cas de cancers du sein dans la famille, est-ce une forme familiale ?
Les formes familiales de cancer du sein pourraient représenter de 15 à 20 % des cas. Le risque de cancer du sein est plus grand chez les femmes dont un proche parent a ou a eu cette maladie. Les membres d'une famille peuvent être du côté paternel ou maternel.
Le fait d'avoir un seul parent au premier degré (mère, sœur ou fille) atteint d'un cancer du sein double presque le risque de développer un cancer du sein. S’il existe plus d’une femme touchée de la famille, au premier et au second degré, on parle d’une forme familiale de cancer du sein.
Il faut se rappeler que certaines patientes peuvent avoir dans leur famille une autre personne ayant été touchée par la maladie. Cela ne signifie pas pour autant que leur cancer est héréditaire. Il peut s’agir d’un simple effet du hasard, en particulier pour des cancers très fréquents, comme le cancer du sein ou du colon.
Est-ce une forme familiale ou simple hasard ?
Il peut aussi s’agir d’une susceptibilité familiale qui accroît légèrement le risque à ce cancer. Cette susceptibilité familiale peut être :
- Parfois génétique… Le facteur génétique peut, par exemple, déterminer l’âge de la puberté et des premières règles et celui de la ménopause, facteurs de risque pour le cancer du sein.
- Souvent, elle est liée au fait que les membres de la famille sont soumis aux mêmes facteurs de risque venant de l’environnement ou d’habitudes familiales alimentaires ou toxiques (tabac, alcool).
Les autres facteurs
LE SEXE
Le simple fait d'être une femme est le facteur de risque principal de développer un cancer du sein. Bien que le cancer du sein puisse affecter un homme, son incidence est environ 100 fois moindre que chez la femme.
L' ÂGE
Le risque qu’a une femme de développer un cancer du sein augmente avec l'âge. Les trois quarts des femmes souffrant d’un cancer du sein ont plus de 50 ans au moment du diagnostic. Les femmes de moins de 30 ans représentent 0,3% des cas de cancers du sein. Les femmes de la trentaine représentent 3,5% des cas.
Mise à jour
25 février 2025

