L'hématopoïèse
Produire quotidiennement 440 milliards de cellules sanguines ...
L'HÉMATOPOÏÈSE
C’est l’ensemble des phénomènes qui concourent à la fabrication et au remplacement continu et régulé des cellules sanguines ayant une durée de vie limitée :
- Un à trois jour pour les polynucléaires (globules blancs)
- Une semaine pour les plaquettes
- Quatre mois pour les hématies
- Quelques mois pour les monocytes
- Quelques mois à plusieurs années pour les lymphocytes
C'est un phénomène physiologique, dynamique et continu qui assure une production quotidienne de 440 milliards de cellules sanguines. Ceci correspond, à la production de plus de 200 milliards d’hématies, d'environ 200 milliards de plaquettes et de 40 milliards de polynucléaires.
LE LIEU DE L'HÉMATOPOÏÈSE
Chez le fœtus, elle s’effectue au niveau du tissu conjonctif embryonnaire jusqu’au 2ème mois. Elle est localisée dans le foie et la rate du 2ème au 6ème mois. Elle devient médullaire (dans les os) à partir du 4ème mois ce qui coïncide avec le développement des ébauches des os.
Après la naissance l’hématopoïèse normale est localisée exclusivement dans la moelle osseuse.
Des cellules qui ont une durée de vie courte...
| Sang | Demi-vie | Nombre total circulant | Production quotidienne |
|---|---|---|---|
| Globules rouges | 120 jours | 2 000 milliards | 200 milliards |
| Polynucléaires neutrophiles | 6 heures | 50 milliards | 40 milliards |
| Monocytes | Quelques mois | ||
| Lymphocytes | Quelques mois à plusieurs années | 10 milliards | |
| Plaquettes | 1 semaine | 100 milliards | 200 milliards |
La moelle osseuse et le sang
LA MOELLE OSSEUSE
Sa localisation
La moelle osseuse hématopoïétique est localisée dans les os plats, sternum, côtes, vertèbres ou os iliaques et dans les épiphyses des os longs. Cependant, jusque l’âge de 5 ans, tous les os ont une activité hématopoïétique.
La moelle osseuse se divise en moelle jaune, adipeuse et involuée, et en moelle rouge, siège préférentiel de l’hématopoïèse.
Sa structure et son contenu
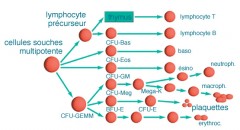
La moelle osseuse est composée principalement de deux types de cellules souches multipotentes : les cellules souches hématopoïétiques et les cellules souches mésenchymateuses.
Les cellules souches hématopoïétiques donnent les lignées myéloïdes (neutrophiles, éosinophiles, basophiles, monocytes, macrophages, érythrocytes et thrombocytes) et lymphoïdes (lymphocytes T, lymphocytes B, lymphocytes NK [natural killers]) formant le système immunitaire.
Les cellules souches mésenchymateuses se différencient en adipocytes, ostéoblastes et chondrocytes, cellules de base de l'os.
Ces deux types de cellules souches sont localisées dans la même niche ou unité fonctionnelle, et sont dépendantes l’une de l’autre pour leur survie.
Les cellules souches mésenchymateuses sécrètent des facteurs de croissance contrôlant la prolifération, la différenciation des cellules souches hématopoïétiques ou leur maintenance dans un état multipotent
Un organe lymphoïde
Outre sa fonction d’organe producteur de cellules sanguines, la moelle se comporte également comme un organe lymphoïde primaire car elle assure la différenciation et la maturation des lymphocytes B, impliqués dans la défense de l’organisme contre les agents infectieux.
LE SANG PÉRIPHÉRIQUE
Les cellules sanguines sont, pour la plupart d’entre elles, très différenciées et représentent les éléments terminaux et fonctionnels des trois lignées sanguines.
Elles n’ont pas ou peu de possibilités de synthèse protéique et de division cellulaire ; les globules rouges (hématies) et les plaquettes n’ont même pas de noyau cellulaire.
Les quatre compartiments de l'hématopoïèse
- Les cellules souches totipotentes à multipotentialité, pouvant se différencier en différents types de cellules du sang
- Les progéniteurs : cellules souches engagées dans un lignage cellulaire
- Les précurseurs se divisent et maturent
- Les cellules matures fonctionnelles passent dans le sang et ne se divisent plus
Les cellules souches hématopoïétiques (CSH)
LES CELLULES SOUCHES
Une cellule souche tissulaire assure l’homéostasie (équilibre entre production et mort cellulaire) du tissu dans lequel elle est...
Toutes les cellules sanguines sont produites à partir d’une même cellule indifférenciée : la "cellule souche totipotente".
L'homéostasie c'est le maintien physiologique d’un organe ou d’un tissu, en remplaçant les cellules mortes, que ce soit naturellement ou après une lésion, assurant ainsi la pérennité de la fonction de l’organe pendant la vie de l’individu.
Leur spécificités
Elles sont localisées dans la moelle osseuse et très peu dans le sang périphérique.
Elles sont peu nombreuses (0,01 – 0,05% des cellules médullaires) et non identifiables morphologiquement.
Elles expriment le marqueur de surface CD34+
A l’état normal, la majorité d'entre elles sont au repos en G0 du cycle cellulaire ; environ 150 sont sollicitées chaque jour . Comme la plupart sont quiescente, elles sont protégées des agressions comme la radiothérapie ou la chimiothérapie pendant quelques semaines.
Elles ont la capacité d’auto-renouvellement, c'est-à-dire la possibilité de créer de nouvelles cellules souches
La division asymétrique
Les cellules souches totipotentes possèdent deux propriétés caractéristiques, celle de s'auto-renouveler et celle de se différencier.
- L’auto-renouvellement
Pour ce faire, la cellule souche se multiplie à l’identique pour éviter le tarissement du réservoir de cellules souches et maintenir, à l’identique, le pool de cellules souches. - La différenciation
En réponse à un signal extérieur de croissance, la cellule souche se divise et en se différenciant, perd de façon irréversible sa totipotence pour devenir une cellule souche « engagée ».
Leur localisation
Elles sont localisées dans la moelle osseuse mais certaines peuvent passer temporairement dans le sang. Elles ne représentent que 0,01 à 0.05 % des cellules médullaires et ne sont pas identifiables morphologiquement. Elles sont, pour la plupart quiescentes, en dehors du cycle cellulaire, en stade G0.
Leur caractéristiques
Les cellules souches possèdent à leur surface des protéines spécifiques, ou CD (Cluster of Differentiation) , reconnaissables par anticorps monoclonaux :
- Marqueurs positifs : CD 34+, Ckit+, Rhodamine (Rho)+, Thy1+
- Marqueurs négatifs : HLA-DR- (HLA de Classe II), CD38-, CD 33-
Elles sont résistantes aux médicaments cytotoxiques de chimiothérapie, à l'irradiation et à la congélation, propriété utilisée pour les greffes de moelle osseuse.
La notion de "niche cellulaire"...
Les cellules souches sont souvent localisées dans des environnements cellulaires qui les protègent, appelés "niches".
Ces niches sont composées non seulement des cellules souche, mais également d'autres types cellulaires de soutien qui génèrent un environnement riche en facteurs et molécules servant à maintenir l'état indifférencié des cellules souches.
Les cellules souches hématopoïétiques sont en contact avec les cellules stromales (cellules du tissu de soutien) de la moelle osseuse.
La plupart des cellules souches prolifèrent assez peu dans la niche dans laquelle elles se trouvent.
Elles doivent sortir de cet environnement cellulaire pour pouvoir proliférer intensivement et se différencier.
LA RÉGULATION DU SYSTÈME
Lors d'une hématopoïèse normale, il existe un équilibre entre la production des cellules souches par division cellulaire (auto-renouvellement) et la perte des cellules souches par engagement vers les lignées cellulaires (différenciation).
Marqueurs servant à l'identification des cellules souches...
| Marqueurs positifs | Marqueurs négatifs |
|---|---|
|
CD34+ : présent, mais non spécifique |
HLA-DR- : HLA classe II |
Les progéniteurs communs...
Elle est commune à plusieurs lignées, myéloïde ou lymphoïde.
Par la suite, le progéniteurs deviennent spécifiques des lignées lorsqu'ils deviennent progéniteurs "engagés".
Chaque progéniteur est défini par l'association d'un préfixe et de lettres représentant des abréviations anglaises :
- Un préfixe : CFU pour Colony Forming Unit
- De(s) lettre(s) qui caractérisent les lignées dont elles gardent le potentiel de différenciation, comme, par exemple, GEMM = Granuleuse, Erythrocytaire, Macrophage et Mégacaryocyte, L pour lymphocytes
Ils représentent seulement 0,1 % des cellules médullaires mais c''est un compartiment quantitativement important, environ une cellule pluripotente pour 1 000 cellules.
Ils possèdent des marqueurs antigéniques de surface (immunophénotype) : CD 34+, CD 33 +, HLA-DR +.
Ils sont sensibles aux facteurs externes ainsi qu'aux facteurs de croissance médullaires.
LES DEUX GRANDES VOIES DE DIFFÉRENTIATION
La cellule souche lymphoïde (progéniteur commun lymphoïde - CFU-L)
- Les lymphocytes T, CD4+ (auxiliaires ou helper - Th) ou CD8+ (cytotoxiques), Treg (régulateurs), après le passage par le thymus
- Les lymphocytes B
- Les cellules "tueuses" NK pour Natural Killer
Elle va poursuivre son programme de différenciation et donner naissance à des progéniteurs encore plus engagés.
Les précurseurs des cellules du sang périphérique
LEURS CARACTÉRISTIQUES
Ils se trouvent dans la moelle osseuse et ont perdu toute capacité d’auto-renouvellement.
A chaque stade de maturation correspond une division cellulaire : les 2 cellules filles issues d’une mitose sont différentes de la cellule mère...
Ce sont les premières cellules morphologiquement identifiables de chaque lignée sanguine :
- L'aspect du noyau : polylobé
- Le cytoplasme contenant des granulations
- Les membranes exprimant des marqueurs de surface
Ils sont mis en évidence en réalisant un myélogramme ou une ponction biopsie ostéomédullaire (BOM).
LEURS RÔLES...
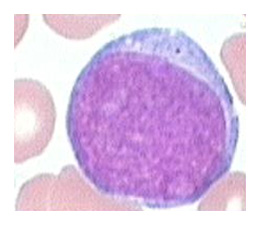
Les précurseurs ont pour buts la multiplication et la maturation cellulaire. Les précurseurs des lignées sanguines les plus immatures portent un suffixe en blaste :
- Les lymphoblastes, précurseurs des lymphocytes
- Les myéloblastes, précurseurs des polynucléaires (l’image montre un myéloblaste que se caractérise par un très gros noyau)
- Les proérythroblastes, précurseurs des globules rouges (hématies)
- Les mégacaryoblastes, précurseurs des plaquettes
- Les monoblastes, précurseurs des monocytes lesquels se différencient en macrophages fonctionnels qui migrent vers le compartiment tissulaire
LE COMPARTIMENT DE MATURATION
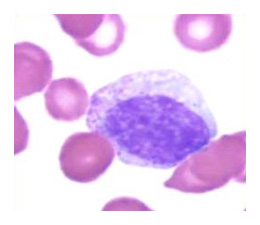
Normalement, les précurseurs des cellules du sang périphérique avec le suffixe blaste, mûrissent et se transforment en cellules plus matures dont le suffixe devient alors cyte . Les modifications morphologiques liées à la maturation des cellules sanguines sont communes aux trois lignées et sont caractérisées par :
- La diminution de la taille des cellules
- La diminution de la taille du noyau de la cellule (diminution du rapport nucléo-cytoplasmique)
- La disparition des nucléoles
- La condensation de la chromatine au niveau du noyau de la cellule. Si l’on compare l’image d’un myélocyte, à celle d’un myéloblaste, plus haut, on reconnaît la diminution de la taille du noyau et la condensation des composants de ce dernier.
L'ensemble de ce processus de maturation dure environ deux semaines, notion importante pour la surveillance des traitements de chimiothérapie.
Vers les cellules matures...
LE MÛRISSEMENT FINAL...
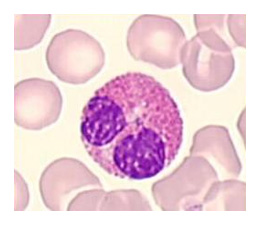
L’aspect du noyau se modifie et devient polylobé pour certains globules blancs, d'où le terme erroné de polynucléaire qui tendrait à dire que la cellule à «plusieurs noyaux».
L'aspect du cytoplasme se transforme, avec l'apparition de granulations spécifiques à chaque type de polynucléaires, polynucléaires neutrophiles, éosinophiles ou basophiles.
Par exemple, sur l’image, de ce polynucléaire, les granulations du cytoplasme apparaissent rouges, il s’agit d’un polynucléaire éosinophile.
Les protéines constituant la membrane extérieure des cellules
Elle se modifient avec apparition de protéines membranaires spécifiques, les CD pour cluster of Differenciation , reconnaissables par les anticorps monoclonaux spécifiques
DANS LE SANG ET LES AUTRES TISSUS
Seules les cellules mûres fonctionnelles, vont passer dans le sang. Il s'agit des polynucléaires neutrophiles, éosinophiles et basophiles, des hématies, des plaquettes, des lymphocytes et des monocytes.
Pour la plupart de ces cellules, le sang ne représente qu'un lieu de passage et de transport entre leur lieu de production (la moelle) et le lieu de leurs fonctions (les tissus).
Les lymphocytes et les monocytes seront, de plus, capables de nouvelles différenciations après leur séjour dans le sang périphérique :
- Les monocytes circulants se transforment en macrophages résidents
- Les lymphocytes peuvent se transformer en lymphocytes T effecteurs ou "mémoires" ou en lymphocytes B sécrétant des anticorps ou en lymphocytes B "mémoires"
Une régulation très précise de l'hématopoïèse
ELLE DOIT ÊTRE FINEMENT RÉGULÉE.
Ceci est essentiel pour maintenir, en dépit des variations de consommation importantes liées à des circonstances pathologiques, comme une hémorragie, nécessitant la production rapide de globules rouges ou une infection, impliquant la production de globules blancs, le nombre de cellules sanguines demeurent à peu près constant au cours du temps.
Cette régulation repose sur des mécanismes cellulaires et humoraux (facteurs de croissance) qui peuvent être stimulateurs ou inhibiteurs de l'hématopoïèse.
Les cellules souches de la moelle constituent la base indispensable à une hématopoïèse efficace.
LES ÉLÉMENTS RÉGULATEURS
Ils jouent un rôle important pour obtenir une hématopoïèse correcte et régulée.
Le microenvironnement médullaire
Outre les cellules de l’hématopoïèse, les organes hématopoïétiques sont constitués d’un stroma ou microenvironnement, qui comporte une composante cellulaire et une matrice extra cellulaire.
La composante cellulaire
Elle comprend, des fibroblastes spécialisés, des adipocytes, dérivés des myofibroblastes, des macrophages, des lymphocytes, des cellules endothéliales (des capillaires et des sinusoïdes), des cellules souches de divers types, donnant naissance à des cellules du mésoderme et divers types de cellules germinales, mais non hématopoïétiques.
Les diverses cellules stromales sont une source de facteurs de croissance, et les contacts cellules stromales – CSH sont nécessaires.
La matrice extra cellulaire (MEC)
Elle est composée de diverses protéines fibreuses, glycoprotéines et protéoglycanes qui sont produites par les cellules stromales. Elle procure aux cellules souches les conditions anatomiques et intercellulaires satisfaisantes pour assurer l'hématopoïèse.
Les matrices extracellulaires permettent l'adhésion des cellules souches, en particulier grâce au collagène.
Les autres facteurs
- Les vitamines sont nécessaires à la synthèse de l'ADN (B12, folates)
- L'insuline, l' IGF1 (IGF - insulin growth factor) et IGF2 potentialisent les effets de l’érythropoïétine (EPO)
- L'hormone de croissance (GH) favorise l'érythropoïèse.
- Le cortisol, la dexaméthasone et les corticoïdes stimulent la formation colonies érythroïdes et potentialisent la production de granulocytes et de macrophages.
- Les hormones thyroïdiennes potentialisent l'érythropoïèse.
- Les androgènes agissent au niveau du CFU-S et permettent la mise en cycle des cellules.
La régulation négative
Elle est assurée par des facteurs d’origine cellulaire différente :
- Les interférons qui sont un groupe de protéines définis par leur propriété antivirale et qui jouent un rôle antimitotique sur les cellules normales ou leucémiques
- Le TGF (Transforming Growth Factor) est une protéine qui exerce un effet inhibiteur sur la pousse in vitro des progéniteurs précoces
- Le TNF (Tumor Necrosis Factor) synthétisé par les monocytes et les lymphocytes T
D'autres molécules, notamment la lactoferrine produite par les polynucléaires neutrophiles, inhibent la synthèse de G-CSF par les monocytes ou l'isoferritine acide et les différentes prostaglandines.
100 millions de leucocytes, 50 billions de globules rouges et les plaquettes assurent...
- L'oxygénation des tissus de l'organisme
- La lutte contre les infections
- La protection endothéliale et la lutte contre les hémorragies
Les facteurs de croissance médullaires
QUI SONT-ILS ?.
Les facteurs de croissance hématopoïétiques sont des glycoprotéines qui agissent comme des hormones.
A l'exception de l'érythropoïétine (EPO) et de la thrombopoïétine produites à distance respectivement dans le rein et le foie, tous les autres facteurs de croissance sont synthétisés localement par un grand nombre de cellules présentes dans divers organes : cellules endothéliales, fibroblastes, monocytes / macrophages, lymphocytes T.
Ces facteurs de croissance portent aussi le nom de cytokines et pour celles synthétisées par les lymphocytes, de lymphokines et d'interleukines (IL).
Ces cytokines reconnaissent leurs cellules cibles par l'intermédiaire de récepteurs membranaires spécifiques.
LEURS RÔLES
Ils agissent à faible concentration et de manière synergique et parfois redondante. Selon leur lieu d'application au cours de l'hématopoïèse, il existe trois grands types de facteurs de croissance.
Les facteurs de promotion de la cellule souche
Ils augmentent le nombre de cellules souches en cycle cellulaire et sensibilisent les cellules souches multipotentes à l'action des autres facteurs de croissance. Pour parvenir à ces effets, deux groupes de cytokines doivent interagir pour aboutir à une action positive :
- Le groupe 1 comprend le facteur de croissance médullaire SCF (Stem Cell Factor) et le flt3/flk2-L
- Le groupe2 est composé par des interleukines, IL6, IL11, IL1, le facteur inhibiteur leucémique LIF (Leukemia Inhibitory Factor) , le G-CSF et la thrombopoïétine, TPO
Les facteurs agissant sur les progéniteurs multipotents
L'interleukine (IL3)
Sa synthèse est extra médullaire (lymphocytes T, mastocytes et cellules gliales). Elle induit une prolifération des progéniteurs, favorise une différenciation de toutes les lignées (sauf érythroblastique).
Le facteur de croissance des cellules Granuleuses et des Macrophages (GM-CSF - CSF pour Colony Stimulating Factor).
Il est synthétisé par les monocytes, les fibroblastes, les lymphocytes T et les cellules endothéliales (après activation par IL-1). Il active production du CFU-GEMM .
L'IL-7
Elle impliquée dans la maturation de la série lymphoïde.
Ces facteurs agissent sur les cellules souches les plus immatures après sensibilisation par les facteurs de promotion. Ils permettent la survie et le mûrissement (différenciation) des cellules souches.
Les facteurs restreints
Ils agissent sur les cellules souches engagées ou progéniteurs et favorisent la multiplication cellulaire et la maturation des précurseurs.
- Le G-CSF permet la maturation des polynucléaires neutrophiles
- Le M-CSF permet la maturation des monocytes
- L'IL-5 permet la maturation des polynucléaires éosinophiles
- L'IL-4 permet la maturation des polynucléaires basophiles
- L'IL-6 et la thrombopoïétine (TPO) permettent la maturation des mégacaryocytes qui donnent naissance aux plaquettes
- L'IL7 permet la maturation des lymphocytes B et T
- L'érythropoïétine (EPO) stimule la production de globules rouges
La plupart des facteurs de croissance restreints peuvent maintenant être produits par génie biologique par des techniques dites recombinantes. Ces facteurs sont très utilisés, en particulier en cancérologie, lorsqu'il est nécessaire de stimuler l'hématopoïèse lors de la chimiothérapie ou de la radiothérapie. Les produits suivants sont couramment prescrits :
- Du G-CSF : Granocyte™, Neupogen™, Neulesta™
- De l'EPO : Eprex™, NeoRecornom™ et Aranesp™
- Du TPO : Nplate™, le Revolade™ qui est un agoniste des récepteurs à la thrombopoïétine
Les autres éléments intervenant dans l’hématopoïèse
- Des vitamine, notamment la vitamine B12 et les folates
- Des oligoéléments et minéraux : fer, cuivre, zinc
- Des acides aminés.
- La pression en oxygène qui est de 4 % dans les vaisseaux sanguins et de 1 % dans les niches hématopoïétiques car les CSH fonctionnent en hypoxie chronique (manque d'oxygène).
Les examens pour explorer les compartiments de l'hématopoïèse
| Sang | Moelle osseuse | Moelle osseuse & sang |
|---|---|---|
|
Cellules matures |
Précurseurs |
Progéniteurs : cultures clonogéniques (7j - 14 j), numération des cellules CD34+ |
Mise à jour
7 juillet 2022

