Les tumeurs malignes
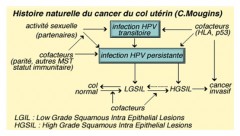
L'évolution des dysplasies peut se faire vers un cancer du col invasif...
Le passage d'un stade de dysplasie à un autre se fait de façon progressive, le plus souvent en relation avec la persistance de l'infection par l'HPV. Cependant, cette évolution n'est pas inéluctable puisqu'on considère qu'une dysplasie peut :
- Régresser spontanément
- Se stabiliser
- S'aggraver, l'aboutissement ultime étant l’émergence d’un cancer invasif avec la rupture de la membrane basale.
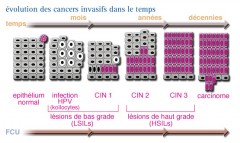
La transformation est un phénomène s'inscrit dans la durée. Il se passe environ 10 ans, entre le moment où apparaît une modification du tissu recouvrant le col de l’utérus (dysplasie intra-épithéliale) et le développement d’un cancer non invasif in situ. A ce stade, les cellules cancéreuses du col de l’utérus restent à l'intérieur de l’épithélium. Elles n'ont pas envahi le tissu avoisinant. Les cellules malignes du col de l’utérus ne sont pas susceptibles de donner des métastases.
L’évolution des lésions est résumée par le schéma ci-dessous.
Les lésions précancéreuses en augmentation mais le nombre de cancers en diminution...
Le taux d’incidence annuel pour 100 000 standardisé Monde des lésions précancéreuses du col a augmenté de 2 % en moyenne chaque année, passant de 26,1 en 2000 à 30,1 en 2009.
Dans le même temps, le taux d’incidence des cancers invasifs diminuait de 7,1 en 2000 à 6,2 en 2009 (−1,3 % par an).
Le ratio (nombre de lésions précancéreuses/nombre de cancers invasifs) a donc augmenté au cours du temps, passant de 2,8 en 2000 à 3,4 en 2009.
En 2009, les lésions précancéreuses représentaient les trois quarts de l’ensemble des lésions du col (précancéreuses et invasives).
L’âge médian au diagnostic était de 51 ans pour les cancers invasifs et de 37 ans pour les lésions précancéreuses.
L’augmentation de l’incidence des lésions précancéreuses et la diminution de celle des cancers invasifs sont attribuées à l’efficacité du dépistage par frottis.
Les différentes étapes...
- Col normal, infection à HPV
- Dysplasie légère (33 ans) ==> régression 50 % des cas
- Dysplasie moyenne ==> régression 30 % des cas
- Dysplasie sévère (cancer in situ - 36 ans)
- Cancer invasif (> 45 ans)
Ne pas se perde dans le maquis des différentes nomenclatures !
| O.M.S. |
Richart |
Bethesda 2001 |
|---|---|---|
|
Dysplasie légère |
Condylome |
Lésion intra-épithéliale de bas grade (LSIL) |
|
Dysplasie légère |
CIN1 avec koïlocytose |
Lésion intra-épithéliale de bas grade (LSIL) |
|
Dysplasie moyenne |
CIN2 avec ou sans koïlocytose |
Lésion intra-épithéliale de haut grade (HSIL) |
|
Dysplasie sévère |
CIN3 avec ou sans koïlocytose |
Lésion intra-épithéliale de haut grade (HSIL) |
|
Carcinome in situ (CIS) |
CIN3 avec ou sans koïlocytose |
Lésion intra-épithéliale de haut grade (HSIL) |
|
Carcinome invasif |
Carcinome épidermoïde invasif |
Carcinome épidermoïde invasif |
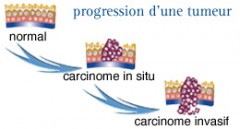
Les cancers invasifs
LES ÉTAPES
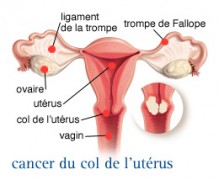
Le cancer du col utérin correspond à un carcinome épidermoïde (malpighien) dans 90 % des cas ou à un adénocarcinome dans moins de 10 % des cas.
C’est un cancer d’évolution lente qui est précédé par des lésions intraépithéliales appelées néoplasies intra épithéliales cervicales (Cervical Intra-epithelial Neoplasia, CIN).
Habituellement la maladie évolue en quatre étapes principales :
- Métaplasie touchant l’épithélium au niveau de la zone de transformation, en relation avec l’infection à HPV,
- Persistance de l’infection virale par l’HPV,
- Progression des anomalies de l’épithélium infecté vers un état précancéreux,
- Cancer avec invasion de la membrane basale.
IL N'Y A AUCUN SYMPTÔMES A CE STADE...
Les modifications précoces produisent rarement des symptômes et passent donc souvent inaperçues Localement, la tumeur évolue en augmentant de volume. En fonction de sa taille et de son siège, la tumeur peut envahir le vagin ou les organes avoisinants.
Le signe d'alerte est une perte de sang (métrorragie) à l'occasion de rapports sexuels...
NON TRAITÉ...
L'évènement le plus fâcheux, au cours de la croissance d'un cancer, est la dissémination des cellules tumorales au-delà de l’utérus vers d’autres organes (métastases).
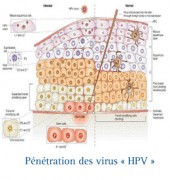
Cancer invasif & infection à Papillomavirus (HPV)....
LE CYCLE VIRAL…
L'infection de la couche basale...
Le virus HPV infecte seulement les cellules épithéliales et dépend du cycle de la différenciation des cellules épithéliales pour compléter son cycle de vie. Il infecte préférentiellement les cellules de la couche basale de l'épithélium du col de l’utérus sur laquelle repose les différentes autres couches de cellules.
L’infection se fait, probablement par l'intermédiaire de microlésions de la surface du col de l’utérus, fréquentes, par exemple, lors des rapports sexuels.
Le virus profite alors de l'extension latérale des cellules basales qui accompagne la cicatrisation de ces microlésions pour pénétrer dans ces cellules. L’internalisation infectieuse dans la cellule prend plusieurs heures, après quoi l'ADN du HPV est libéré de sa capside (membrane entourant et protégeant le matériel génétique du virus) et est transporté dans le noyau comme matériel génétique libre (épisome extra-chromosomique).
La réplication virale
L'expression des gènes précoces des gènes viraux est très étroitement contrôlée dans les cellules de la couche épithéliale basale avec, cependant, une amplification de l'ADN viral.
La réplication du virus HPV se produit seulement dans les cellules supra-basales qui sont destinées à remplacer les cellules « âgées » ou « mortes » mais qui n'expriment pas naturellement la machinerie permettant la réplication du virus dépend pour sa survie.
Les protéines virales 6 et E7...
Pour contourner ce problème et se dupliquer, le génome du virus HPV code pour deux protéines — E6 et E7 — qui, ensemble, vont promouvoir la prolifération cellulaire, prolonger la progression du cycle cellulaire et empêcher l'apoptose (mort cellulaire programmée) des cellules destinées à disparaitre. Ces cellules deviennent alors « permissives » à la réplication virale et des centaines ou même milliers de génomes d’HPV peuvent alors être générés dans une seule cellule.
Les protéines virales de la capside L1 et L2
Elles sont alors exprimées dans les couches les plus superficielles de l'épithélium du col de l’utérus, où à lieu l’assemblage final entre le matériel génétique du virus HPV et de sa capside. Les nouvelles particules virales infectieuses (virions) se détachent alors de la surface épithélial.
Le cycle de maturation du HPV
Il dure de 2 à 3 semaines ce qui représente le temps mis par une cellule du col de l’utérus pour migrer de la couche basale vers la couche superficielle du col. Ce sont ces cellules qui sont examiner dans les frottis de dépistage.
LA TRANSFORMATION MALIGNE...
L’expression des gènes viraux dans l’épithélium
Il est régulée par la différenciation de l’épithélium. Le matériel génétique du Papillomavirus, L1 puis L2 puis E4 , E6 et E7, s’intègre dans l'ADN du noyau de certaines cellules constituant le col de l'utérus.
Pour permettre un cycle complet de réplication du virus, la cellule doit permettre l'assemblage du virion et sa libération.
En cas d’infection par des papillomavirus à haut risque
Les gènes viraux E6 et E7 bloquent les régulateurs négatifs du cycle cellulaire et les cellules restent activement impliquées dans la progression du cycle cellulaire et leur capacité d'apoptose disparait. L'instabilité génomique qui en résulte induit des altérations génétiques qui vont progressivement s'accumuler et conduire la cellule infectée par le HPV à une cellule cancéreuse invasive.
Les protéines virales E6 et E7, encore...
Les protéines générées à partir des gènes E6 et E7 initient l’oncogenèse au travers d’interactions avec certains gènes suppresseurs de tumeurs (TP53 codant la protéine E6 et le gène du rétinoblastome (RB) codant pour la protéine E7).
Le gène TP53 , gardien du génome, joue un rôle crucial en forçant une cellule anormale à aller vers l'apoptose ou en provoquant l'arrêt de son cycle cellulaire jusqu'à ce que les erreurs dans la réplication de son ADN soit être réparées. La protéine virale E6 cible le TP53 impliqué dans la dégradation des cellules mutées par la voie de l'ubiquitine, en empêchant l'apoptose et permettant ainsi aux cellules mutées de se répliquer.
La protéine virale E7 contribue à l'oncogenèse en se liant avec les protéines issues des gènes membres de la famille du rétinoblastome (RB). Le résultat de cette interaction conduit à la libération et à l'activation de la transcription de la protéine E2F, conduisant à l'expression des gènes de phase S, y compris ceux encodant les cyclines A et E, qui, vont, à leur tour, permettre l’entrée de la cellule dans le cycle cellulaire et permettre la synthèse de l'ADN viral.
L’évasion immunitaire
Le développement du cancer dépend non seulement de la dérégulation du contrôle du cycle cellulaire mais aussi d’anomalie du système immunitaire, permettant au virus d'être « invisible » durant de longues périodes et de ce fait, aucune réaction inflammatoire n’est induite. De plus, les antigènes viraux ne sont détectables que dans les cellules épithéliales superficielles destinées à la desquamation et donc à distance du système de surveillance immunologique.
Les papillomavirus à haut risque ont par ailleurs élaboré de nombreuses stratégies leur permettant de minimiser les risques de détection par le système immunitaire.
Les réponses immunitaires naturelles à l’infection
En dépit des efforts considérables mis en œuvre pour permettre « l’évasion immunitaire », la majorité des infections de papillomavirus sont guérissent en moins d’un an.
Pour cela, sont impliqués dans l’élimination des virus, l’immunité à médiation cellulaire et la production d'anticorps contre la protéine de capside virale L1.
LES TROIS TYPES D'INFECTION
L’infection latente
Elle est définie comme la pénétration du virus au niveau des cellules basales de l’épithélium sans expression des gènes viraux dans aucune des cellules de l’épithélium.
L’infection productive
Elle est caractérisée par l’expression des gènes viraux tardifs (L1 et L2) dans les cellules intermédiaires et superficielles du col de l'utérus .
Cela permet la réplication et l’expression de particules virales complètes dans les cellules superficielles de l’épithélium car, comme nous l'avons vu, il n’existe pas d’expression du virus dans les couches basales de l'épithélium constituant le col de l'utérus.
Cette infection productive est fréquente chez les femmes jeunes et régresse le plus souvent spontanément.
L’infection transformante
Elle peut se produire après ou de manière concomitante à une infection aiguë productive dans les couches basales.
L’expression des gènes viraux précoces ( E6 et E7 ) dans les couches basales conduit à une instabilité chromosomique.
L'intégration du génome viral est un phénomène tardif dans la progression des lésions précancéreuses vers un cancer invasif. Elle se fait au voisinage de proto-oncogènes ou anti-oncogènes des cellules souches. Les particules virales sont alors en position de dérégler le cycle cellulaire.
Cette intégration du matériel génétique viral va progressivement conduire à des désordres de la croissance cellulaire et aboutir à un cancer non invasif, intra-épithélial in situ puis à un cancer invasif.
LA CINÉTIQUE...
Il faut de 10 à 15 ans entre la première infection à papillomavirus et l'apparition du cancer, ce qui suggère que plusieurs phénomènes successifs sont à l'origine de la cancérisation et explique l'épidémiologie de cette maladie.
Un cancer est découvert, quand a-t-il commencé ?
Entre 5 et 10 ans entre l'émergence des premières cellules cancéreuses et une tumeur mesurant entre 0,5 et 1,5 cm
Temps de doublement de taille d’une tumeur maligne : 3 mois environ
La progression de la maladie
ATTEINTE DES GANGLIONS LYMPHATIQUES
Cela signifie que certaines cellules cancéreuses ont eu la capacité de sortir du col de l’utérus pour former d'autres colonies tumorales en dehors du col. Il existe donc un risque que d'autres cellules aient suivi le même processus pour aller dans d'autres organes du corps. C'est pourquoi il est important de déterminer si le cancer du col s'est étendu aux ganglions lymphatiques afin de mettre sur pied le meilleur traitement.
Les chaînes ganglionnaires touchées sont, d’abord dans le pelvis, les ganglions pelviens, puis ceux situés le long de l’aorte, les ganglions para-aortiques.
LES MÉTASTASES
Les métastases se font par migration des cellules tumorales soit par voie lymphatique soit par voie sanguine. Les organes touchés le plus fréquemment sont l'os, le foie et le poumon.
Vos interrogations...
- L'infection à HPV est nécessaire mais pas suffisante
- La transmission sexuelle se produit entre 16-25 ans, suivi d'une période de latence
- Un intérêt démontré de la vaccination du (des) partenaire(s)
Une prévention par la vaccination des filles et des garçons à partir de 11 ans ferait disparaitre la maladie !
Mise à jour
26 juillet 2022

