Les principes généraux
Les origines
PAUL ERLICH
C'est à Paul Erlich, médecin allemand (1854 - 1915), Prix Nobel de physiologie et de médecine en 1908 que revient la création du terme chimiothérapie. Le nom chimiothérapie dérive du grec khêméia qui se traduit par chimie et de thérapéia qui veut dire traitement .
QUELLE CIBLE ?
Dans une tumeur, seules les cellules capables de se reproduire indéfiniment, les cellules souches sont dangereuses. Ce sont elles que l'on veut détruire par la chimiothérapie.
Les autres cellules, celles qui se multiplient mais ne s'auto-renouvellent pas ou pour quelques générations seulement, et celles qui se différencient, aboutissent à un processus de mort "naturelle", ne sont pas la cible de la chimiothérapie. Ce sont elles qui contribuent au volume tumoral.
UNE DÉFINITION
Une substance antitumorale (anticancéreuse, antinéoplasique, cytotoxique) se définit comme une substance cytotoxique qui détruit sélectivement les cellules transformées.
- Les molécules susceptibles de tuer les cellules cancéreuses actives, c’est-à-dire celles qui se multiplient et prolifèrent, sont appelées cytotoxiques.
- Les substances qui arrêtent la croissance cellulaire sont désignées sous le terme de cytostatiques.
Ces substances permettent d'inhiber ou d'empêcher la fabrication de matériaux utiles à la cellule pour se reproduire. Ces molécules agissent en endommageant le matériel héréditaire, c'est-à-dire les chromosomes et plus spécifiquement l'ADN, permettant de transmettre les caractères de la cellule mère à la cellule-fille. Ceci aboutit à la mort de la cellule.
NATURE & CHIMIE
Sur plus de 200 médicaments anticancéreux homologués, hors thérapies ciblées et immunothérapies, ce sont, quant leur origine :
- Des substances naturelles : 17 %
- Des substances naturelles légèrement modifiées : 31 %
- Des molécules synthétiques : 26 %
- Des molécules synthétiques à partir d'une structure naturelle : 10 %
Les premiers pas…
LA SERENDIPITÉ
Le mot anglais serendipity
Il fut créé par l'écrivain Horace Walpole le 28 janvier 1754 dans une lettre à Horace Mann, envoyé du roi George II à Florence. Il dérive d'un conte persan publié en 1557 par le Vénitien Michele Tramezzino, les Trois Princes de Serendip (Serendip est le nom de Ceylan ou Sri Lanka en vieux persan). Dans ce conte, les princes qui voyageaient beaucoup, faisaient toujours des découvertes, soit par accident ou par sagacité, de choses auxquelles ils n'avaient pas pensé...
La sérendipité est le don ou la faculté de trouver quelque chose d'imprévu et d'utile en cherchant autre chose, ou encore, l'art de trouver ce qu'on ne cherche pas.
Par exemple, la découverte des propriétés antibactériennes de la pénicilline par Alexander Fleming est dite avoir été sérendipitienne, parce qu'il nettoyait seulement son laboratoire quand il a découvert que la moisissure Penicillium avait contaminé l'une de ses anciennes expériences.
C'est une notion qui recouvre les découvertes fortuites et qui s'applique à toutes les sciences. L'accent important réside moins dans le concours de circonstances accidentelles qui amène l'observation que dans le parti qui est tiré de cette observation fortuite par la sagacité de l'inventeur. Selon un dicton connu, des milliers de gens avaient déjà vu tomber des pommes avant Isaac Newton et aucun n'en avait imaginé pour autant la gravitation universelle.
Le 2 décembre 1943, une odeur d'ail envahi le port de Bari en Italie...
L’idée d’une chimiothérapie anticancéreuse résulte de la mise en évidence que des dérivés de moutardes azotées, eux même dérivés des gaz de combat de la première guerre mondiale, étaient capables de provoquer un blocage de la moelle osseuse (aplasie).
La preuve, pour ainsi dire, en a été fournie lors de l’explosion d’un stock de gaz moutarde (ypérite ou gaz H) dans le port de Bari le 2 décembre 1943, au cours de la Seconde guerre mondiale. Les futs endommagé laissèrent fuir du gaz à l'odeur caractéristique d'ail et de nombreux matelots moururent ainsi intoxiqués.
Le médecin militaire, Steward Alexander fut charger de l'enquête. Il constata quelques semaines plus tard que les matelots présentaient une baisse importante du taux de globules du sang et certains d'entre eux développaient une aplasie médullaire.
Dans son rapport du 20 juin 1944, il fit part de ses constatations, en particulier sur la destruction pratiquement complète des globules blancs chez les intoxiqués.
En dépit du "secret militaire" couvrant cet épisode de la dernière guerre, Alfred Gilman (1908-1984) et Louis S Goodman (1906 - 2000), tous deux pharmacologues à l'université de Yale, furent chargés d'étudier les effets toxiques du gaz moutarde et de trouver une antidote.
La mise en évidence d'une toxicité élective pour les tissus lymphoïdes fut la première étape qui mena à la découverte des alkylants et les premiers essais avec le Mustargen™.
LES PIONNIERS….
Alfred Gilman
A partir des constations de Stewart Alexander et plus tard de Cornelius P. Rhoads faites à Bari, il développa des dérivés, dont la caryolysine, qui furent testés à Yale sur des malades souffrant de maladie de Hodgkin, alors mortelle à 100 %. A la fin de la Seconde Guerre Mondiale, les premières réponses chez des patients souffrant d’une maladie de Hodgkin ou d’un lymphome traités par une moutarde azotée, la caryolysine furent publiées.
Par la suite...
Les autres médicaments alkylants, développés ultérieurement, auront, parfois, un index thérapeutique meilleur. Par exemple, le cyclophosphamide, commercialisé en 1950, reste l’un des médicaments les plus utilisé de nos jours !
Après l'aminoptérine, avec laquelle Sidney Farber (1903-1973), un pédiatre pathologiste, en 1948, avait observé des réponses transitoires dans la leucémie aiguë de l'enfant, le méthotrexate est le second antifolate à être développé et commercialisé.
Charles Heidelberger (1920 - 1983), pharmacologue américain, à la même époque, développe le premier analogue des pyrimidines, le 5-FluoroUracile (5FU) et l'année suivante, avec ce médicament, sont décrites des réponses dans les cancers digestifs, le cancer du sein et certains cancers de la sphère ORL. Depuis, la recherche de nouveaux médicaments anticancéreux a permis la mise au point de médicaments plus efficace et mieux tolérés.
LA SYSTÉMATISATION DE LA RECHERCHE…
Au cours des années, l'objectif de la chimiothérapie a évolué du soulagement des symptômes vers l'obtention de rémissions complètes durables. Il faut souligner que, maintenant, la chimiothérapie à la capacité de traiter les cancers étendus ou métastatiques, là où les traitements locaux, chirurgie ou radiothérapie, ont une efficacité limitée.
La recherche s’est, par la suite, systématisée à partir de l’initiative du National Cancer Institute (NCI) qui a mis en place dès 1955, un criblage de molécules sur la base d’un modèle de leucémie de la souris. De plus, en 1970, cette recherche s'est intensifiée avec le lancement du programme Conquête du Cancer par le président américain Richard Nixon.
MAINTENANT….
Les découvertes récentes de biologie moléculaire ont débouché sur de nouveaux axes thérapeutiques n'utilisant plus l'atteinte cytotoxique comme moyen de guérir la maladie, mais plutôt des médicaments capables de freiner l’apparition des métastases ou de bloquer leur développement.
Ces nouvelles molécules, n'entraînent pas obligatoirement la mort des cellules cancéreuses, mais réduisent considérablement leur potentiel délétère. Ce sont les biochimiothérapies ou thérapies ciblées .
Pourquoi cela demeure encore un traitement important ?
- Dès le début, un cancer peut donner des métastases qui échappent aux traitements comme la chirurgie ou la radiothérapie.
- La chimiothérapie cytotoxique, l’hormonothérapie, l’immunothérapie et les thérapies ciblée sont des thérapeutiques systémiques
- Les traitements systémiques ont pour objectif de détruire les cellules cancéreuses disséminées dans l’organisme, suspectées ou détectées
Le cycle cellulaire
UN PETIT RETOUR EN ARRIÈRE ...
C'est en 1953 qu'Alma Howard Rolleston Ebert, biologiste canadienne (1913 - 1983) et Stephen Pelc, utilisant des traceurs radioactifs, démontrèrent que la synthèse d’ADN se réalisait durant l’interphase, une période réduite de la vie de la cellule et montrèrent que les processus de division cellulaire et de duplication des chromosomes sont deux processus temporellement dissociés.
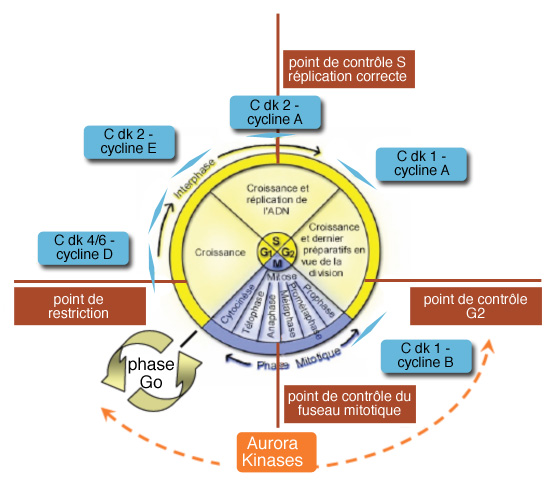
Ils ont par la suite montré l’existence d’un cycle cellulaire constitué de 4 phases successives : G1, S, G2 et M.
Entre 1987 et 1990, le régulateur universel de l’entrée en mitose (le MPF) est caractérisé : c’est une kinase cycline-dépendante (Cdk) associée à une cycline.
Entre 1990 et 2000, une douzaine de cyclines / Cdk sont décrites chez l’homme. Six d’entre elles interviennent dans le contrôle direct du déroulement du cycle cellulaire.
UN ROLE ESSENTIEL
Le cycle cellulaire
Il à pour finalité d'assurer, d’une part, l’ordre immuable de la succession des quatre phases du cycle (régulation du cycle), et d’autre part, l’obtention de deux cellules filles rigoureusement identiques (surveillance de l’ADN). Pour cette fonction essentielle, la cellule dispose de systèmes de régulation hautement perfectionnés.
Pour la régulation du cycle cellulaire, ce sont essentiellement des kinases cycline-dépendantes, les Cdk, qui interviennent. D’autres molécules interviennent dans différents mécanismes de surveillance du cycle pour inhiber les Cdk de la régulation du cycle et arrêter le cycle, si l’étape précédente n’est pas terminée, ou si une « réparation » est nécessaire.
Pour les organismes eucaryotes
Il est indispensable que les différentes phases du cycle cellulaire soient précisément coordonnées. Les phases doivent suivre un ordre correct, et une phase doit être termine avant que la phase suivante ne démarre. Les erreurs de coordination peuvent conduire à des altérations chromosomiques. Des chromosomes ou des parties de chromosomes peuvent être perdus, réarrangés ou distribués de manière inégale entre les deux cellules filles. Ces types d'altérations chromosomiques sont plus souvent le fait des cellules cancéreuses.
LES DIFFÉRENTES PHASES
Le cycle cellulaire se compose de 4 phases
C'est l'intervalle qui sépare 2 divisions cellulaires.
C'est une succession ordonnée de phases commandant des événements importants qui aboutissent à la division cellulaire ou mitose. Il comprend les phases consécutives :
- G0 : phase de repos très variable et, de fait, plus une tumeur est différenciée, plus le temps de doublement est long.
- G1 (Gap1) : entrée en cycle s'étendant sur moins de 3 jours de présynthèses de l'ADN, suivi, soit d'une sortie du cycle cellulaire avec la phase G0, soit d'une phase S de synthèse de l'ADN. La progression en phase G1 nécessite la participation des cyclines de type D qui répondent aux facteurs de croissance au niveau du point de restriction, moment où la cellule prend la décision d'entrer en phase S.
- S : réplication de l’ADN en 8 à 12 heures
- G2 : période entre la phases S et la mitose en quelques heures de pré-division
- M : mitose et dure moins de 2 heures
La progression du cycle à travers ces 4 étapes se fait sous le contrôle de points de transition ou check-points. Une fois le cycle démarré, il ne peut revenir en arrière. Les cellules peuvent poursuivre le cycle au bout d’un temps variable, ou bien mourir.
Une fois la division cellulaire terminée une cellule peut sortir du cycle en G0, ou redémarrer et rentrer en G1.
Les cellules peuvent soit "cycler" indéfiniment (cellules immortelles) ou un nombre limité de fois pour répondre aux besoins de l’organisme : peau, muqueuses, globules blancs …
La cellule, au cours de sa vie, va connaître successivement plusieurs phases. Il existe, pour elle, trois options :
- Suivre le cycle de façon continue
- Quitter le cycle temporairement pour entrer dans une phase G0 dite de quiescence
- Quitter le cycle définitivement et mourir, par apoptose, sans participer à une nouvelle division.
LES CHECK-POINTS
Leur rôles
La progression du cycle à travers ces 4 étapes se fait sous le strict contrôle des check-points qui sont régulés par de multiples protéines dont les kinases dépendantes de cyclines (CDK - sérine-thréonine kinase) et les cyclines. Les gènes CDK contrôlent les différents passage du cycle cellulaire, et la concentration des protéines CDK est constante.
Les CDK
Les kinases dépendantes du cycle sont au nombre de huit : cdk1 à cdk8. Les cdk agissent en partenariat avec les cyclines, dont 8 ont été clonées dénommées de A jusqu’à H.
Le complexe CDK-cycline
Au cours du cycle, CDKs et cyclines se rapprochent et participent à la formation et l'activation d'un hétéro-complexe.
Cette activation est à l'origine de messages clés pour le cycle cellulaire. En effet, le complexe permet la phosphorylation de substrats protéiques spécifiques nécessaire au passage à la phase suivante.
L'activité de ce complexe est contrôlée par une famille de protéines inhibitrices de kinase appelée cyclin dependent kinase inhibitor.
LES MECANISMES DE SURVEILLANCE
Les mécanismes de surveillance s’ajoutent à la régulation de la succession des quatre phases du cycle par les Cdk. Ils permettent la surveillance d’aspects fondamentaux comme :
- L'état des molécules d’ADN avant, pendant et après leur réplication (DDCP = DNA Damage Checkpoint),
- L’achèvement total de la réplication avant l’entrée en mitose (RCP = Replication Checkpoint)
- Le bon positionnement de tous les chromosomes sur la plaque métaphasique avant la séparation des chromatides-sœurs (MPC = Mitotic Checkpoint).
LA REGULATION DU CYCLE
En phase G0 et début de phase G1, Rb1 (r pour rétinoblastome) est protéine qui exerce un contrôle négatif du cycle cellulaire. En phase G0, elle forme un complexe avec un facteur de transcription E2F. Le complexe Rb1/E2F inhibe l’activité transcriptionnelle.
La protéine p16 inhibe l’activité de l'activité des kinases dépendantes des cyclines CDK4/6.
Des signaux de prolifération vont induire la transcription de la cycline D qui va former un complexe avec les CDK4/6 et phosphoryler la protéine Rb1. La phosphorylisation de la protéine Rb1 va libérer le facteur de transcription, E2F. Une fois libéré de Rb1, il va induire la transcription de gènes, comme la cycline E et de CDK2.
Le complexe CDK2-cycline E va "hyper-phosphoryler" la protéine Rb1, permettant de maintenir l’activité transcriptionnelle de E2F et ainsi déclencher le passage du cycle cellulaire en phase S.
LA FINALITÉ DU CYCLE CELLULAIRE
Le renouvellement des tissus
L’organisme perd plusieurs millions de cellules par seconde et doit donc en renouveler autant.
La cicatrisation
C’est la régénération d’un tissu après une agression.
La base théorique : les phases de la division cellulaire
LA MITOSE
La prophase
La chromatine commence à se condenser. De nombreux changements ont lieu dans le cytoplasme. Les centrosomes, dupliqués en interphase, se séparent et entament leur migration à deux pôles diamétralement opposés dans le noyau. Ils formeront les futurs pôles du fuseau mitotique.
La réorganisation des composants du cytosquelette interphasique conduit en périphérie de l’enveloppe nucléaire à la formation du fuseau mitotique à partir des centrosomes, dont l’activité nucléante augmente.
L’enveloppe nucléaire commence à se désagréger.
La prométaphase
Au cours de la phase tardive de la prophase, ou prométaphase, la membrane nucléaire se désagrège complètement sous forme de petites vésicules membranaires. La condensation des chromosomes continue.
Le fuseau mitotique s’organise dans toute la cellule. Il est constitué de microtubules polaires, astraux et kinétochoriens. Ces derniers capturent les chromosomes au niveau de leurs centromères par l’intermédiaire d’une structure protéique appelée le kinétochore. C’est le début des mouvements de congression des chromosomes.
La métaphase
Elle est caractérisée par une condensation maximale des chromosomes.
Les chromatides sœurs sont alors physiquement liées l’une à l’autre uniquement grâce aux cohésines centromériques. Chaque chromatide de chaque paire de chromosomes est reliée à un pôle opposé du fuseau mitotique par l’intermédiaire des microtubules kinétochoriens. A la fin des mouvements de congression, les chromosomes sont alignés sur un même plan, la plaque métaphasique.
L'anaphase
Elle marque la séparation des chromosomes à deux chromatides en deux lots égaux de chromosomes à une chromatide et le début de leur décondensation.
Chacune des deux chromatides sœurs d’un même chromosome sont tirées vers un pôle opposé de
la cellule par les microtubules kinétochoriens, qui se dépolymérisent à mesure de la progression de la migration des chromosomes.
Les microtubules polaires, quant à eux, s’allongent pour préparer la future séparation des deux cellules filles.
La télophase
Les chromosomes achèvent leur décondensation et les enveloppes nucléaires des cellules filles se reconstituent.
Le fuseau mitotique se dépolymérise progressivement.
LA CYTOCINESE
C'est le processus qui permet la séparation physique des deux cellules filles en fin de mitose. Un anneau contractile, constitué principalement de filaments d’actine et de myosine, se forme autour de la membrane plasmique. Il conduit à l’apparition d’un sillon de division marqué par l’invagination de la membrane cytoplasmique, dans un plan perpendiculaire à l’axe du fuseau.
La mitose, en bref...
INTERPHASE : chromosomes non individualisés - Chromatine 1 centrosome
PROPHASE : 2 centrosomes - 1 Chromosome = 2 chromatides liées au niveau des centromères + 2 kinétochores
PRO-MÉTAPHASE : plus de membrane nucléaire - Attachement des chromosome aux microtubules via le centromère
MÉTAPHASE : tous les chromosomes à l’équateur. (Un chromosome non aligné envoie un signal inhibiteur)
ANAPHASE : séparation des kinétochores - Migration des chromatides séparées vers les pôles
TÉLOPHASE ET CYTOKINÈSE : Partage de la cellule - Reconstitution de la membrane nucléaire autour de chaque lot de chromosomes et décondensation des chromosomes
La perte du contrôle de la durée de la mitose
La durée de la mitose est étroitement contrôlée. La mitose dite « prolongée » est caractéristique des cellules « problématiques » sujettes à la ségrégation chromosomique et à l'instabilité génomique.
L'allongement de la mitose aboutit à la formation de complexes protéiques protéiques p53-binding protein 1 (53BP1)-ubiquitine-specific protease 28 (USP28)-p53. Ces complexes protéiques sont par la suite transmis aux cellules filles et conservés de manière stable par celles-ci.
Au décours d'une mitose prolongée, les complexes sont assemblés par un mécanisme dépendant de la Polo-kinase et provoquent une réponse p53 en G1. Cette réponse empêche la prolifération des lignées cellulaires présentant une mitose trois fois plus longue ou des mitoses successives moins longues.
Dans certains cancers avec une mutation p53 et certains de type sauvage p53 (p53-WT), la capacité de surveiller l'extension mitotique est perdue, ce qui est cohérent avec la classification de TP53BP1 et USP28 en tant que gènes suppresseurs de tumeurs.
Les cancers conservant la capacité de surveiller l'extension mitotique sont plus chimio-sensibles.
LES DIFFÉRENTS TYPES DE MÉDICAMENTS
TOUT D'ABORD
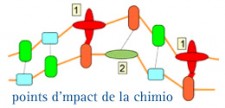
Certains médicaments sont dits « cycle dépendants ». Ces molécules n’agissent que sur les cellules engagées dans le cycle cellulaire quelle qu’en soit la phase comme, par exemple, les agents alkylants.
Les produits « phase dépendants » ne sont actifs que pendant une phase précise du cycle comme, par exemple, les poisons du fuseau mitotique qui sont actifs en phase "M"
LES CONSÉQUENCES PRATIQUES
On désire utiliser un produit « cycle-dépendant »
Il faut préalablement faire entrer les cellules dans le cycle cellulaire en les sortant de la phase G0. Ceci peut être obtenu soit par une réduction de la masse tumorale, soit par l’utilisation d’une anthracycline (adriamycine, épirubicine).
On projette d'employer un produit « phase-dépendant »
Il faut préalablement bloquer les cellules dans le stade correspondant par exemple en phase M avec un alcaloïde de la pervenche ou en phase S avec du méthotrexate. Le blocage en phase S permet d’obtenir l’efficacité optimale des antimétabolites.
ENFIN...
Les tumeurs ayant peu de divisions cellulaires seront donc peu touchées par les médicaments de chimiothérapie.
Les limites
LES EFFETS COLLATÉRAUX...
Il n'y a pas encore de médicaments spécifiques aux cellules cancéreuses. Il en résulte que tous les médicaments utilisés sont, peu ou prou, toxiques pour les cellules normales. Ceci a comme effet collatéral de toucher, en même temps, les tissus sains se renouvelant rapidement comme les cellules sanguines, les cellules des muqueuses ou de la peau. Ceci explique les effets secondaires rencontrés avec la chimiothérapie « cytotoxique ».
LA RÉSISTANCE
Certaines cellules cancéreuses sont résistantes aux médicaments de chimiothérapie. Cette résistance peut être d’emblée ou résistance innée ou secondaire, après exposition à des médicaments cytotoxiques ou résistance « acquise ».
Ces cellules sont présentes dès que la tumeur primitive atteint 2 à 3 mm de diamètre. Ce sont celles contenues dans les métastases, autrement dit les cellules cancéreuses qui ont migré, à distance, à partir d'une tumeur primitive. Elles développent plusieurs types de mécanismes de défense qui leur permettent de se débarrasser des produits toxiques. Ces processus de défense, d'origine génétique, sont mis en œuvre par la cellule elle-même.
Un autre processus de résistance fait intervenir le transport en sens inverse du produit toxique à travers la membrane de la cellule, de l'intérieur vers l'extérieur de celle-ci (pompe à efflux).
Les obstacles à la diffusion de la chimiothérapie
LA VASCULARISATION DE LA TUMEUR
Si les cellules cancéreuses sont mal irriguées ou plus ou moins quiescentes, ce qu'on observe au centre de la tumeur, elles reçoivent moins de médicaments antimitotiques et sont donc moins sensibles au traitement. Ceci explique l’intérêt d'une chirurgie « première » dite de « réduction » dans le traitement de certaines localisations de cancers, comme le cancer de l'ovaire.
La radiothérapie entraîne des modifications importantes de la vascularisation autour de la tumeur traitée. Si une récidive survient dans le territoire irradié, la tumeur est alors souvent « chimio-résistante » car la zone est alors mal irriguée par le sang et une très faible quantité de médicament, atteindra les cellules tumorales pour la détruire.
LA BARRIÈRE HÉMATO-ENCÉPHALIQUE
La plupart des médicaments anticancéreux sont de grosses molécules complexes et peu solubles dans les milieux biologiques. Ils ne peuvent donc pas passer la « barrière hémato-encéphalique », interface peu « pénétrable » entre le sang, le liquide céphalo spinal « LCS » et le tissu cérébral. Celle-ci empêche la plupart des médicaments anticancéreux de pénétrer dans le cerveau et donc d’atteindre les tumeurs cérébrales primitives ou les métastases cérébrales. Seules les petites molécules, liposolubles, peuvent traverser la barrière hémato-encéphalique. De ce fait, ces cellules tumorales sont très résistantes à la chimiothérapie car celle-ci ne peut les atteindre.
LES CHIMIOTHÉRAPIES DÉLIVRÉES LOCALEMENT
L'utilisation d'une chimiothérapie intrapéritonéale, par exemple, a pour but d'augmenter la concentration médicamenteuse au niveau des métastases péritonéales d'une tumeur ovarienne ou digestive. Dans ce cas, la chimiothérapie a un effet « contact » et ne peut, par conséquent, concerner que les tumeurs planes n'excédant pas quelques millimètres d'épaisseur.
La perfusion d’un membre « isolé », est une technique utilisée pour traiter les sarcomes des tissus mous ou des ostéosarcomes.
Mise à jour
29 mars 2024

