Selon le stade
La proposition thérapeutique va reposer sur le bilan initial de la maladie...
- Le repérage de la lésion, en collaboration avec le chirurgien et le radiothérapeute
- La lecture au microscope des lames préparées par le médecin anatomopathologiste à partir des fragments reçus de la biopsie va permettre de déterminer les caractéristiques de la tumeur
- L'évaluation de son grade sbr : 1, 2 ou 3
- La détermination du score Ki67 (dans le cas de tumeur RH+ HER2-) : score faible (≤ 10) versus score élevé (>30)
- La présence ou non de récepteurs hormonaux (RH) œstrogènes (RE) et progestérone (RP) ainsi que leur niveau d’expression
- La recherche d’une surexpression ou non du facteur de croissance HER 2/neu
- La détermination du phénotype de la tumeur (classification biomoléculaire)
Toute la stratégie thérapeutique va prendre en compte.......
- La taille de la tumeur "T"
- La présence ou non de récepteurs hormonaux "R" ; les tumeurs exprimant le récepteur à l’estradiol (RE+) seront traitées par hormonothérapie
- Les « triple négatifs »(RE-/RP-/HER2-) relèveront de traitements spécifiques
- Le grade histologique sbr : 1 bien différencié à 3, indifférencié
- La surexpression de l’oncoprotéine HER2 déterminera un traitement par anti-HER2 de type "trastuzumab"
- L'âge < 35 ans versus > 35 ans
AU STADE 0 DE CANCER NON-INVASIF
LE CONTEXTE
Ce sont des cancers découverts à l’occasion d’une mammographie de dépistage. Le traitement du carcinome canalaire in situ (CIS) et du carcinome lobulaire in situ (CLIS), sont très différents.
EN CAS DE CARCINOME LOBULAIRE in situ (CLIS)
L’abstention & un suivi régulier ...
Les femmes présentant un CLIS peuvent, dans certains cas être simplement surveillées. Cependant, le fait d'avoir un CLIS est un facteur de risque de développer ultérieurement un cancer invasif.
Un suivi rapproché des deux seins est important car une femme ayant un CLIS d'un sein a un risque équivalent de développer un cancer du sein du même côté ou du côté opposé. Il comprend une mammographie annuelle et un examen clinique des seins deux fois par an.
Vous pouvez aussi envisager de prendre part à un essai thérapeutique de prévention primaire du cancer du sein, avec un médicament appelé SERM , comme le tamoxifène ou le raloxifène.
Un traitement chirurgical
Certaines femmes peuvent opter pour une mammectomie bilatérale simple, c'est-à-dire une ablation des deux seins sans curage des ganglions lymphatiques.
L’intervention a pour but de prévenir le développement d'un cancer invasif. Cette intervention, prophylactique, concerne surtout les femmes qui ont des facteurs de risque comme une forte hérédité de cancer du sein. Selon les préférences de la patiente, celle-ci peut considérer une reconstruction mammaire immédiate ou retardée.
EN CAS D'UN CARCINOME CANALAIRE in situ (CCIS)
Le traitement dépend des résultats de la mammographie et de la biopsie. Il faut savoir que dans ce cas plus de 95 % des femmes sont en voie à 10 ans.
Le traitement chirurgical et radiothérapie
La chirurgie conservatrice oncoplastique suivie d’une radiothérapie de l’ensemble de la glande mammaire de 50 Gy est le traitement de référence des carcinomes canalaires in situ du sein localisés unifocaux du sein. L’irradiation mammaire postopératoire réduit le risque de rechute locale invasive de 50 % et celui de rechute in situ de 40 %.
Une mammectomie peut être nécessaire dans les cas suivants :
- La taille de la tumeur est grande
- Le sein contient des zones multiples de CCIS
- La tumeur ne peut pas être totalement enlevée au cours d'une tumorectomie, c'est-à-dire que les échantillons de prélèvements de la tumorectomie ont des marges positives donc contenant encore des cellules cancéreuses
Beaucoup plus rarement que pour le CLIS, pour certaines femmes présentant des facteurs de risque, l'équipe médicale peut vous proposer une mammectomie bilatérale simple, c'est-à-dire une ablation des deux seins sans curage des ganglions lymphatiques. Dans tous les cas de figure, la reconstruction mammaire peut-être immédiate ou différée.
Un traitement hormonal
Ce n’est pas une option recommandée, en dehors du cadre d’un essai thérapeutique bien que des essais suggèrent que le tamoxifène puisse diminuer le risque de développement d'un cancer invasif après le traitement du CIS par tumorectomie et radiothérapie.
AU STADE I
LE TRAITEMENT CHIRURGICAL (LOCORÉGIONAL)
Le traitement conservateur
C'est l'option habituelle. Il s'agira d'une tumorectomie associée à un curage ganglionnaire (ablation des ganglions lymphatiques axillaires, sous les bras). Un simple prélèvement portant sur le ganglion lymphatique « sentinelle » peut être utilisé à la place du curage standard des ganglions lymphatiques. La chirurgie conservatrice est suivie systématiquement d'une radiothérapie.
La mammectomie
En cas de lésions multiples, l'autre option est la mammectomie radicale modifiée (ablation du sein et des ganglions axillaires) avec ou sans reconstruction immédiate du sein.
LE TRAITEMENT ADJUVANT
Tumeur < 1 cm et aucun ganglion touché (N0)
Une chimiothérapie complémentaire (adjuvante) n'est, le plus souvent, pas nécessaire, en l’absence d’atteinte des ganglions (N0) et si la tumeur T :
- T< 1 cm et de grade sbr 1
- Récepteurs hormonaux (RE/RP+)
- HER2 négative,
Néanmoins, même pour les petites tumeurs de moins de 1 cm, une chimiothérapie est souvent recommandée si les cellules tumorales présentent certains signes d’agressivité comme un haut grade histologique ou une absence d'expression de récepteurs aux œstrogènes par les cellules tumorales. Elle aussi indiquée pour les patientes jeunes avant la ménopause.
Tumeur > 1 cm (N0)
Un traitement adjuvant par chimiothérapie, suivant un schéma séquentiel d’anthracycline-cyclophosphamide et taxane (AC-T) vous sera proposé dans les cas suivants :
- La tumeur a une taille supérieure à T > 2 cm
- La tumeur n’a pas de récepteurs hormonaux ER/PR-
- La tumeur est de grade histologique sbr 2 ou 3
- Le score Ki67 (tumeur RH+ HER2-) >30
- Vous êtes âgée de 35 ans ou moins
Tumeur > 1 cm ou atteinte d’au moins un ganglion (N+)
Si la taille de la tumeur est supérieure à 1 cm ou si au moins un ganglion axillaire est touché, une chimiothérapie adjuvante est recommandée car environ un cancer sur quatre à ce stade peut se révéler agressif.
Si les cellules tumorales contiennent des récepteurs aux œstrogènes, un traitement d’hormonothérapie pendant 5 ans pourra être considéré.
Tumeur est HER2+ (quelle que soit la valeur de T et de N)
On vous proposera un traitement par l’Herceptin™, seule ou en association avec la chimiothérapie en traitement adjuvant.
- Un protocole avec anthracyclines nécessitant, une surveillance régulière du cœur
- Un FEC suivi de taxane (Taxol™ ou Taxotère™), en association avec Herceptin™
- Un protocole taxane (Taxol™ ou Taxotère™) + Herceptin™ suivi d'un FEC
- Le protocole doxorubicine, cyclophosphamide, paclitaxel ( Taxol™) et Herceptin™ (ACTH)
- Un schéma sans anthracycline
- Taxotère™ + Carboplatine™ + Herceptin™ en même temps (TCH)
- Taxotère™ + Carboplatine™ + Herceptin™ en même temps (TCH)
La durée du traitement par Herceptin™ est d’un an, en l’absence d’une contre-indication à la poursuite du traitement, ou d’une rechute du cancer du sein.
IMORTANT !
- Si une chimiothérapie et une radiothérapie adjuvantes sont indiquées, la chimiothérapie est le plus souvent réalisée en premier.
- La radiothérapie doit débuter au plus tard 6 mois après la chirurgie et au maximum 5 semaines après la chimiothérapie.
AU STADE II
LE TRAITEMENT LOCORÉGIONAL PREMIER
La chirurgie
La taille de la tumeur et le rapport de celle-ci avec la taille du sein sont des paramètres importants pour choisir entre une mammectomie (ablation du sein) ou un traitement conservateur. Il faut savoir qu’en cas de tumorectomie (ablation seule de la tumeur), le chirurgien enlève en plus de chaque côté de la tumeur une collerette de tissu apparemment sain d’environ 1 cm pour essayer d’enlever d’éventuelles ramifications qui ne seraient pas visibles à l’œil nu.
Certaines situations incitent plus à proposer une mammectomie qu’un traitement conservateur :
- Une tumeur située près de l’aréole et du mamelon
- L'existence d’au moins deux tumeurs éloignées l’une de l’autre
- Des microcalcifications étendues évocatrices de lésions de carcinome invasif ou in situ
Le traitement adjuvant (complémentaire)
A ce stade, une radiothérapie et une chimiothérapie sont de règle après la mammectomie si la tumeur est importante ou si elle s'est étendue aux ganglions lymphatiques (N+).
LE TRAITEMENT CHIRURGICAL APRÈS UNE CHIMIOTHÉRAPIE NÉO-ADJUVANTE
Pourquoi ?
Une chimiothérapie néoadjuvante/primaire (avant la chirurgie) est une option pour certaines femmes qui souhaitent avoir un traitement conservateur du sein pour des tumeurs ayant entre 2 et 5 cm. Il faut savoir que la taille de la tumeur, par rapport à celle du sein, peut rendre la tumorectomie difficile ou impossible.
Si la chimiothérapie néoadjuvante est capable de réduire suffisamment la taille de la tumeur, une tumorectomie simple peut être envisagée suivie d'une radiothérapie, éventuellement complétée par un traitement systémique (chimiothérapie, avec ou sans hormonothérapie.)
Si la tumeur ne diminue pas suffisamment pour permettre la tumorectomie, le traitement habituel est alors la mammectomie suivie d'une radiothérapie puis, éventuellement, d'un traitement systémique complémentaire différent (chimiothérapie, avec ou sans hormonothérapie).
Les indications
Habituellement, les indications de la chimiothérapie néoadjuvante sont les suivantes :
- La tumeur est HER2+ve, on instaurera un traitement par l’Herceptin™
- La tumeur est de grade sbr 3, et qu’elle n’exprime pas de récepteurs hormonaux (RE-/RP-ve) et si elle est HER2-ve (triple négatif ou basal-like ), une chimiothérapie vous sera proposée
- La tumeur est RE+/RP+ve, de grade sbr 1-2et HER2-ve (luminal A), une hormonothérapie ou une chimiothérapie vous sera prescrite.
Un traitement complémentaire de consolidation (adjuvant)
Il peut comprendre une hormonothérapie, une chimiothérapie anticancéreuse ou les deux, selon l'âge de la patiente, le résultat de la recherche des récepteurs aux œstrogènes et de l'atteinte des ganglions lymphatiques.
Si la tumeur est HER2+, un traitement par l’Herceptin™, seule ou en association avec la chimiothérapie en traitement adjuvant sera proposé.
La tumeur est petite et j'ai besoin d'un traitement complémentaire ...
POURQUOI ?
La nature du traitement adjuvant et son type, chimiothérapie et/ou hormonothérapie, sont déterminés en fonction de la taille de la tumeur, de son extension aux ganglions lymphatiques et des caractéristiques des cellules tumorales, notamment leur grade histologique et la présence ou non de récepteurs aux œstrogènes.
LES OPTIONS
Une chimiothérapie sera proposée, si une des situations suivantes est rencontrée :
- Des cellules tumorales ont été retrouvées dans les ganglions
- La tumeur a plus de 1 cm dans son plus grand axe
- Les cellules tumorales présentent un haut grade histologique ou n’expriment pas de récepteurs aux œstrogènes.
L’hormonothérapie est surtout indiquée, après la ménopause, si les cellules tumorales contiennent des récepteurs aux œstrogènes (RE+).
EN PRATIQUE ...
Lorsque le traitement adjuvant comprend à la fois la chimiothérapie et l’hormonothérapie, il est habituel de débuter par la chimiothérapie après la chirurgie. La chimiothérapie sera suivie de la radiothérapie et de l’hormonothérapie.
Il n’est pas conseillé de prendre en même temps la chimiothérapie et l’hormonothérapie, car ce dernier traitement tend à bloquer la division des cellules tumorales et donc tend à diminuer l’effet de la chimiothérapie qui attaque les cellules qui se divisent.
Le traitement médical adjuvant, en bref...
| Les modalités | Facteurs décisionnels | Fonction de la balance risque/bénéfice |
|---|---|---|
|
La chimiothérapie |
La surexpression ou non de HER2 |
L'âge |
Situations particulières
CANCER BILATERAL
Dans ce cas, les deux tumeurs seront traitées comme un cancer unique en fonction de ses caractères anatomo-cliniques et évolutives tant pour le traitement locorégional que pour le traitement adjuvant.
CANCER BIFOCAL (DEUX TUMEURS DANS UN MEME SEIN)
Ce type de cancer se définit par la présence de deux tumeurs séparées de plus de 2 cm.
Le traitement chirurgical consiste en une mastectomie totale avec preuve histologique sur les 2 lésions. Dans certains cas, on peut vous proposer un traitement conservateur si l’exérèse des lésions est possible. Dans ce cas, une IRM préopératoire est nécessaire pour vérifier l’absence d’autres lésions.- L’évaluation ganglionnaire se fait par un curage axillaire. Un traitement adjuvant sera recommandé selon les mêmes principes que pour les tumeurs uniques. La taille retenue pour la décision est celle de la tumeur la plus volumineuse.
AU STADE III (cancers localement avancés)
AU STADE IIIA
La tumeur est de petite taille T1
Elle traitée par une mammectomie radicale modifiée (avec ou sans reconstruction mammaire) suivie d'une radiothérapie et d'un traitement systémique adjuvant. La tumorectomie est plus rarement une option et dépend de la taille du sein.
La tumeur est de plus grande taille > T2
Ils peuvent être traités par une chimiothérapie "première ou néoadjuvante" (avant la chirurgie) avec ou sans hormonothérapie. Ensuite, une mammectomie radicale modifiée est réalisée, avec ou sans reconstruction.
Dans tous les cas, la chirurgie est suivie d'une radiothérapie et d'un traitement systémique (chimiothérapie avec ou sans hormonothérapie).
Une tumorectomie est rarement une option.
AU STADE IIIB
Ce stade inclut aussi les cancers du sein inflammatoires.
Le traitement consiste en une chimiothérapie néoadjuvante suivie d'une mammectomie radicale ou plus rarement d'une tumorectomie.
Le but du traitement néoadjuvant est de réduire les signes inflammatoires et de diminuer la taille du cancer de telle façon qu'il puisse être enlevé dans sa totalité ou plus facilement par la chirurgie.
La chirurgie est suivie d'une chimiothérapie adjuvante [SIM (Sein Inflammatoire et/ou métastasique) = épirubicine 75 mg/m² + cyclophosphamide 1200 mg/m²].
L’autre option consiste en une mammectomie (en l’absence de signes inflammatoires), une radiothérapie et une chimiothérapie adjuvante administrée, avec ou sans traitement hormonal.
Les patientes peuvent aussi envisager de prendre part à un essai thérapeutique.
AU STADE IV
LE CONTEXTE...
Le choix du traitement dépend de :
- La présence ou l'absence de "crise viscérale" : altération fonctionnelle sévère d'organe, évaluée par la présence de symptômes cliniques, de perturbations biologiques et/ou d'une progression rapide de la
maladie - Vos antécédents : traitement adjuvant ou non de traitement adjuvant
- La présence ou non de RH et/ou d'une surexpression de HER2
- Du type de traitement prescrit : avec ou sans anthracycline avec ou sans taxane
- L'intervalle libre (durée entre le traitement et la rechute) et de l'évolutivité de la maladie métastatique
- Votre état général et, le cas échéant, les effets secondaires rencontrés lors du traitement adjuvant
LES OPTIONS
Le traitement initial comprend une chimiothérapie, une hormonothérapie ou les deux successivement.
Chimiothérapie seule
En monothérapie...
- Eribuline ou capécitabine en première intention, après anthracyclines et taxanes
- Anthracyclines éventuellement liposomales en fonction des doses déjà administrées
- Taxanes donnés éventuellement de façon hebdomadaire ou le nab-Paclitaxel
- Vinorelbine
- Gemcitabine
- Sels de platine
- Cyclophosphamide oral (métronomique)
Les associations avec anthracyclines
- FEC 50 à 100
- SIM (Sein Inflammatoire et/ou métastatique) = Epirubicine 75 mg/m² + cyclophosphamide 1200 mg/m² protocole semi-intensif/ 14 jours quelle que soit la NFS
Associations avec le docétaxel (Taxotère™)
- Taxotère™ monothérapie tous les 21 jours ou hebdomadaire
- Taxotère™ – 5 FU avec infusor sur 3 jours
- Taxotère™ – Xéloda™ (capécitabine)
- Taxotère™ - Navelbine™ (vinorelbine)
Autres lignes
- Oxaliplatine + gemcitabine : J1 oxaliplatine : perfusion de 2 à 6 heures + J1-J8 gemcitabine en perfusion de 30 minutes
- Taxol™ en monothérapie toutes les semaines ou toutes les 3 semaines
- Oral : méthotrexate (J1 et J2/semaine + cyclophosphamide en continu)
LE CAS DES TUMEURS HER2+
L'immunothérapie ± chimiothérapie pour les tumeurs surexprimant HER2
Herceptin™, seule ou en association avec la chimiothérapie (Taxotère™ – Herceptin™ / 21 jours)
Herceptin™ hebdomadaire est une option pour les femmes dont les cellules cancéreuses ont un fort taux de protéine HER2/neu.
L’association docétaxel + trastuzumab + pertuzumab est maintenant validée comme traitement de première ligne de traitement en phase métastatique du cancer du sein surexprimant HER2.
La radiothérapie et/ou la chirurgie
Ces techniques peuvent être aussi utilisées pour soulager certains symptômes. Les traitements pour soulager les symptômes dépendent du lieu où se sont installés les cellules du cancer du sein. Par exemple, des douleurs dues à des métastases osseuses sont traitées par des antalgiques, y compris la morphine et/ou les anti-inflammatoires, mais peuvent aussi être traitées par radiothérapie.
En troisième ligne
En cas de progression de maladie, on peut poursuivre le trastuzumab en changeant la chimiothérapie ou passer au lapatinib (Tyverb™), associé à la capécitabine, ou évaluer l'association du trastuzumab + lapatinib (tumeurs RH-) :
- capécitabine/lapatinib
- capécitabine/trastuzumab
- trastuzumab/lapatinib (RH-)
- trastuzumab/Navelbine
Modalités de traitement au stade métastatique
LA CRISE VISCÉRALE
Elle se définit comme le dysfonctionnement sévère d'un organe caractérisé par la présence de signes et symptômes cliniques, d'anomalies biologiques et d'une progression rapide de la maladie.
LES IMPLICATIONS
En l'absence de crise viscérale
Une hormonothérapie première si cancer RH+
- Inhibiteurs de l'aromatase après la ménopause
- Tamoxifène, en cas de progression
- Association exémestane + evérolimus
- Fulvestrant
- Hormonothérapie + palbociclib (Ibrance™), un inhibiteur des cyclines DK4/6 (ATU de cohorte)
- Piqray™ (alpelisib en cas de tumeur portant une mutation PIK3CA
Les cancers du sein RH+ HER2-
La première ligne de traitement consiste maintenant en une association d'hormonothérapie (inhibiteur de l’aromatase ou fulvestrant) et d'un inhibiteur de CDK4/6 (Ibrance™).
Les cancers du sein HER2+
Le principe général est de maintenir le traitement par un médicament anti-HER2 tout au long de la maladie. En première ligne le choix du traitement est sur l’intervalle libre à partir de la fin de la thérapie adjuvante avec trastuzumab.
Si intervalle libre ≥ 12 mois ou dans le cas d'une évolution vers le stade stade IV, l'option habituelle est une chimiothérapie avec un taxane associée à une immunothérapie : trastuzumab + pertuzumab (Perjeta™) + taxane suivi d'un traitement de maintenance :
- Si la tumeur n'exprime pas de récepteur hormonaux (RH-) : Herceptin™ (trastuzumab) + palbociclib (Ibrance™)
- Si la tumeur exprime des récepteurs hormonaux (RH+) : trastuzumab + pertuzumab + hormonothérapie
Si intervalle libre < 12 mois, l'option est immunothérapie conjuguée par Kadcyla™ (T-DM1).
En présence de crise viscérale
C'est une indication à une indication de chimiothérapie première.
- Une mono-chimiothérapie séquentielle est le traitement standard
- Une poly-chimiothérapie peut être proposée en cas de maladie engageant le pronostic vital à court terme et avec un état général compatible :
- Maladie engageant le pronostic vital à court terme et PS ≤1 nécessitant une cytoréduction rapide : polychimiothérapie
- Maladie cliniquement non agressive et/ou PS >1 : monochimiothérapie
Examens nécessaires pour les nouveaux traitements au stade IV
- L'association d'un inhibiteur de PI3K + traitement hormonal (alpelisib plus fulvestrant) : recherche de mutation de par une méthode de sequencing ou la recherche d'aDN tumoral circulant
- L'association d'un inhibiteur du Poly (ADP-ribose) polymerase (PARP) : recherche de mutations BRCA1 et BRCA2
- L'association d'un inhibiteur de point de contrôle immunologique + chimiothérapie ( pembrolizumab + chimiothérapie) : recherche PDL1 sur la tumeur et les cellules immunologiques
- L'association de deux inhibiteurs de point de contrôle immunologique (dostarlimab-gxly (Jemperli™) + pembrolizumab) : recherche d'une déficience du système de réparation des mésappariements des bases (dMMR)/une instabilité microsatellitaire élevée (MSI-H)+ détermination de la charge mutationnelle
- L'utilisation d'un inhibiteur de TRK ( larotrectinib - Vitrakvi™) : recherche de fusion NTRK ((les protéines issues des gènes fusionnant avec NTRK se comportent comme des “drivers” oncologiques primaires)
Les dernières recommandations
- Cancer "triple-négatif", en situation néoadjuvante carboplatine dans le protocole de chimiothérapie + pembrolizumab
- Cancer avec mutation constitutionnelle de BRCA1/2 : un inhibiteur de PARP (olaparib) comme traitement adjuvant dans les cancers du sein à haut risque de récidive
- Cancers exprimant les récepteurs hormonaux (RH+) à haut risque de récidive, l’abémaciclib en traitement adjuvante
- Cancers ne surexprimant pas HER2 mais HER2-faible : anticorps drogue-conjugués
En cas de métastases cérébrales
QUI EST LE PLUS A RISQUE ?
De 5 à 15 % des cancers du sein développent au cours de leur évolution des métastases cérébrales.
Les métastases cérébrales sont une complication qui se voit plus volontiers en cas de cancer du sein HER2+ et de cancer dit "triple négatif" dans 25 à 50 % des cas selon les études.
En revanche, l'incidence est de 8 % pour les formes luminales A (HER2 non surexprimé, récepteurs des estrogènes et de la progestérone exprimés, indice de prolifération faible) et de 11 % pour les cohortes avec des tumeurs luminales B (HER2 non surexprimé, récepteurs des œstrogènes et de la progestérone exprimés, indice de prolifération élevé). Les facteurs de risque suivants ont été identifiés :
- Un diagnostic de cancer du sein avant l’âge de 40 ans
- La non expression des récepteurs des œstrogènes (RE-)
- Statut triple négatif
- Surexpression du récepteur HER2
- Présence de métastases extra-cérébrales (pulmonaires, hépatiques et lymphatiques)
- Un taux de lacto-déshydrogénase (LDH) élevé (marqueur de la masse tumorale)
Le délai médian de survenue après le diagnostic dépends type de tumeur. Il varie fortement, allant de 2 ans pour les tumeurs triples négatives à 3 ans pour les tumeurs surexprimant HER2, 4 ans pour les tumeurs luminales A et 4.5 ans pour les tumeurs luminales B.
LEUR TRAITEMENT
Il peut faire appel à la chirurgie, la radiochirurgie, à la radiothérapie pan-encéphalique, aux traitements systémiques, seuls ou en association. Le choix thérapeutique est fonction de l’objectif du traitement.
EN CAS DE MÉTASTASES OSSEUSES
LES MOYENS
Leur traitement fait appel à la radiothérapie ou la radiothérapie métabolique, cette dernière étant particulièrement intéressante lors d’atteintes multiples mais limitées.
La chirurgie est surtout prophylactique pour éviter la fracture et les complications liées à la destruction osseuse. Elle a une visée curative lors de fractures vertébrale avec risque d'atteinte de la moelle épinière. Leur traitement a bénéficié de techniques modernes : cimento-vertébroplastie ou radiofréquence.
LES MÉDICAMENTS
Les bisphosphonates
Ce sont des médicaments s'opposent à la décalcification causée par les métastases du cancer du sein. Pour cette indication, ils sont généralement administrés par voie intraveineuse.
De plus, certaines études cliniques ont démontré l’efficacité de certains bisphosphonates pour réduire le nombre d’événements osseux et retarder leur apparition dans le cancer du sein.
Dans une méta-analyse, dont le critère principal est d’évaluer la survenue d’un événement osseux chez des patientes présentant un cancer du sein avec métastases osseuses, les auteurs montrent une réduction de 17 % (intervalle de confiance de 11 à 22 % ; p = 0,00001) du risque d’événements osseux sous bisphosphonates par rapport au placebo. Après un bilan dentaire, du fait du risque de nécrose mandibulaire, le traitement pourra être mis en œuvre.
- L’alendronate (Fosamax™), actif par voie orale à la dose de 70 mg une fois par semaine
- Le clodronate (Clastoban™), actif par voie orale à la dose de 1600 mg par jour
- L’étidronate (Didronel™)
- L'ibandronate (Bondronate ™ ) est actif à la fois par voie orale, 50 mg par jour ou injectable (IV en 2 heures) à la dose de 2 mg
- Le pamidronate (Arédia™), actif par voie injectable (IV en deux heures) à la dose de 90 mg tous les mois
- L’acide zolédronique (Zometa™), actif par voie injectable (IV en 15 minutes) à la dose de 4 mg tous les mois
Pour ces trois médicaments, il est très important de vous hydrater, soit en buvant au moins 3 litres d’eau par jour, soit au moyen d’une perfusion.
Une prise de sang vous sera prescrite pour suivre votre taux de phosphore dans le sang et votre formule sanguine (NFS).
Le Prolia/Xgeva™ (denosumab)
C'est un anticorps monoclonal humain (IgG2) visant le liguant du RANK*, impliqué dans la résorption osseuse. Ce médicament est actif par voie injectable, sous-cutanée (SC).
Il est indiqué dans la prévention des complications osseuses (fractures pathologiques, irradiation osseuse, compression médullaire ou chirurgie osseuse) chez des patients adultes atteints de tumeurs solides présentant des métastases osseuses.
La posologie recommandée est de 120 mg administrés par voie sous-cutanée, une fois toutes les 4 semaines avec une supplémentation apportant au moins 500 mg de calcium et 400 UI de vitamine D.
* Le récepteur RANK (Receptor Activator of Nuclear factor Kappa B) est présent à la surface des ostéoclastes et appartient à la famille des récepteurs au TNF. L’agoniste de ce récepteur RANK est le RANK-L (RANK-ligand), protéine exprimée et libérée par les ostéoblastes et par les lymphocytes T. L’activation du récepteur RANK induit la maturation et l’activation des ostéoclastes et provoque une résorption osseuse.
Le cancer inflammatoire
DE QUOI S'AGIT-IL ?
C'est une forme cliniques agressive de cancer du sein qui représente moins de 5 % des cas. Il est défini cliniquement par :
- La présence d’une rougeur (érythème) occupant au moins un tiers du sein
- et/ou une œdème
- et/ou un aspect dit de « peau d’orange »)
- et/ou sein chaud, avec ou sans masse palpable sous-jacente, d’apparition rapide (≤ 6 mois), avec confirmation histologique d’un carcinome infiltrant.
La surexpression d’HER2 est retrouvée dans 30 à 50 % des cas.
LES OPTIONS
Dans ce cas, les options sont les suivantes :
- Une polychimiothérapie première (néoadjuvante), à base d'anthracyclines pouvant être associée à un taxane (Taxotère™ ou Taxol™)
- L'utilisation de l'Herceptin ™ pour les formes HER2+
- Une mammectomie et curage axillaire après refroidissement, c’est-à-dire après la disparition des signes d’inflammation des ganglions (lymphangite) et une diminution de taille de la tumeur
- Une radiothérapie portant sur la paroi et les chaînes ganglionnaires mammaire interne et sus-claviculaire homolatérales
- Une hormonothérapie adjuvante si la tumeur est RE+ve » et/ou RP+ve.
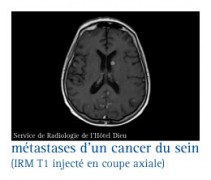
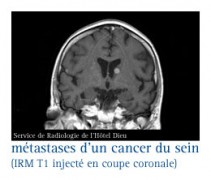
En cas de rechute ou de récidive...
LE CONTEXTE...
En fonction des facteurs pronostiques reconnus, dans le pire des scenarii, le taux de rechute est d'environ 30 % pour les formes sans envahissement ganglionnaire (N0) et de 70% pour les cas N+.
Le pronostic s'est significativement amélioré...
Comme le nombre de patientes ayant rechuté et en vie est de plus en plus important, la prévalence des cancers métastatique augmente.
Les caractéristiques de la maladie et votre état général sont importants pour décider l'option thérapeutique...
Ils seront pris en compte pour décider du type de traitement à mettre en œuvre. Les options pour le traitement initial, comprennent de la chimiothérapie, une hormonothérapie ou les deux successivement.
PLUSIEURS CAS DE FIGURES
Le cancer du sein peut récidiver localement, dans le même sein ou près de la cicatrice de la mastectomie. Il peut aussi récidiver à distance, dans d’autres organes.
La récidive est locale, c'est-à-dire dans le sein opéré
De nos jours, ce type récidive est rare et ne concerne que de 4 à 8 % des cas ayant bénéficié d'une chirurgie conservatrice. Il est plus élevé si la patiente est jeune (facteur indépendant de récidive).
La rechute locale peut se faire sous forme invasive ou in situ. Elle survient la plupart du temps dans les deux premières années et peut faire craindre la survenue de métastases à distance. L'option retenue par l'équipe médicale dépend du traitement initial.
- Si vous avez bénéficié d’un traitement conservateur du sein, une récidive locale est généralement traitée par une mammectomie totale associée ou non à un curage ganglionnaire si celui-ci n'a pas été effectué.
- Si vous avez subi une mammectomie, la récidive près du site de la mammectomie est traitée par l'ablation de la tumeur autant que possible, généralement suivie par une radiothérapie
.
Dans un cas comme dans l'autre, l'hormonothérapie et/ou la chimiothérapie peuvent être utilisés après ou après la chirurgie et/ou la radiothérapie.
La récidive est à distance (métastase)
En cas de métastases osseuses, pulmonaires ou cérébrales, ces lésions sont traitées de la même façon que celles du stade IV avec métastases au moment du diagnostic initial.
Les patientes sont encouragées à prendre part à des essais thérapeutiques.
Il s’agit de métastases osseuses...
Elles sont maintenant dans la plupart des cas maîtrisables. Les traitements font appel aux bisphosphonates administrés soit par voie orale soit par voie ou intraveineuse.
Si vous souffrez, on vous prescrira des antalgiques, y compris la morphine et/ou les anti-inflammatoires. Les douleurs peuvent, aussi, être grandement améliorées par des flash de radiothérapie sur les zones douloureuses.
On peut aussi vous proposer des produits radiomarqués comme le samarium lexidronam (Quadramet™) ou le strontium (Métastron™).
LES OPTIONS SELON LE TYPE DE CANCER
Le cancer est de type luminal
Plusieurs type de médicaments sont possibles comme, le tamoxifène, le fulvestrant, les inhibiteurs de l'aromatase et les médicaments supprimant la fonction ovarienne si vous n'êtes pas ménopausée. Un traitement de maintenance sera institué.
Si la tumeur est HER2+ un traitement par le trastuzumab (Herceptin TM ) ou le lapatinib (Tyverb™) sera ajouté au traitement hormonal.
Le cancer est de type " triple négatif "
Dans ce cas, le traitement de base est la chimiothérapie. Les protocoles sont fonction d'une éventuelle réponse à un traitement antérieur, en particulier si celui-ci contenait une anthracycline (FAC ou FEC). A ce jour, il n'y a pas de supériorité évidente d'un protocole particulier de chimiothérapie, bien que taxanes ou la vinorelbine soient fréquemment proposés.
Le cancer est de type HER2 positif (surexpression ou amplification)
Dans ce cas, l'Herceptin™ seule ou en association avec la chimiothérapie est la meilleure option sous réserve d'un suivi de la fonction cardiaque. On peut aussi vous proposer une association avec une hormonothérapie si la tumeur est RE+ve.
Après progression sous Herceptin™, la reprise de l'Herceptin™ en association avec une nouvelle chimiothérapie est une option. L'autre option est d'utiliser les nouvelles molécules anti-HER2.
Après une deuxième progression sous Herceptin™ , l’association à base de Tyverb ™ (lapatinib) et de Xeloda™ ( capécitabine) ou une autre chimiothérapie si la capécitabine a été préalablement utilisée, est une option validée ; l’association à base de lapatinib et trastuzumab est un traitement raisonnable.
L’inclusion dans des essais clinique est une option à considérer.
En cas de rechute, les options possibles pour contrôler le cours de la maladie...
METTRE EN OEUVRE UNE STRATÉGIE ALTERNATIVE...
Une hormonothérapie sera prescrite avec ou sans chirurgie pour bloquer le fonctionnement des ovaires
Si le cancer récidive seulement dans un seul site, ce qui est rare, le traitement est alors chirurgical avec ou sans radiothérapie
Une radiothérapie en "flash" peut permettre de contrôler les douleurs dues à la propagation du cancer aux os et dans d'autres parties du corps.
Une chimiothérapie de deuxième ou de troisième ligne, voire de quatrième ou de cinquième ligne peut être initiée.
Enfin, la participation à un essai clinique de nouveaux médicaments de chimiothérapie ou d'hormonothérapie, de thérapie biologique peut être une option à considérer.
PRENDRE COMPTE LES INNOVATIONS THÉRAPEUTIQUES...
Les inhibiteurs du cycle cellulaire (inhibiteurs de CDK4/6)
Ces nouveaux médicaments ont été récemment homologués pour les tumeurs RH+ HER2− au stade métastatique en association avec une hormonothérapie. Cette nouvelle option très intéressante de par son efficacité et sa tolérance.
De nouveaux anticorps monoclonaux en cours de développement dans le cadre d'un essai thérapeutique
Ils s'agit du Trodelvy™ (sacituzumab govitecan), qui dispose d'une ATU et du trastuzumab duocarmazine en cours d'évaluation pour le traitement des cancers du sein triples négatifs.
L'utilisation de médicaments ciblant le déficit de réparation de l’ADN
Ce sont les inhibiteurs de PARP pour les patients présentant une mutation BRCA. Leur bénéfice, dans le traitement des cancers du sein avec mutation des gènes BRCA1 et BRCA2, est démontré. Leur utilisation dans les cancers du sein triples négatifs est en cours d’évaluation.
L'efficacité de l’immunothérapie visant les point de contrôle immunitaires en première ligne
C'est une option très prometteuse pour le traitement des formes métastatiques de cancers du sein triple négatifs.
Mise à jour
25 septembre 2022

