Pour les cancers du sein
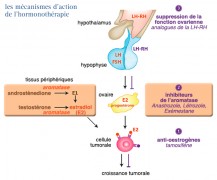
Mode d'action
LA PRESENCE DE RÉCEPTEURS HORMONAUX (RH)
Leur présence, leur surexpression ou leur absence déterminent la stratégie thérapeutique, qu'elle soit chimiothérapique ou hormonale. Leur niveau d'expression est un paramètre important selon que leur niveau d'expression est élevé ou faible. De plus, on sait que la chimiothérapie, notamment chez les N-, marche d'autant mieux qu'il n'y a pas d'expression des RH (ou une expression basse).
L’HORMONOTHÉRAPIE
Le but de ce traitement est de bloquer le fonctionnement du récepteur œstrogène (RE).
En traitement adjuvant, l'objectif est de limiter le risque de récidive locale, d’atteinte du sein restant et d'une dissémination à distance, et d'augmenter la survie à long terme.
Les différents types d'hormonothérapie ont comme objectif d'inhiber la signalisation hormonale à travers deux mécanismes physiologiques : par blocage direct de l’activation des récepteurs à la surface des cellules tumorales grâce à des agents antagonistes ou par blocage de la synthèse des œstrogènes au niveau ovarien ou périphérique.
LES TROIS TYPES HORMONOTHÉRAPIE…
Ils sont tous utilisables dans le traitement des cancers du sein avancés ou en situation adjuvante pour obtenir une suppression de la synthèse d’œstrogènes ovariens :
- Le premier type, chez la femme non ménopausée, consiste en une suppression ovarienne :
- Physique par la chirurgie ou l’irradiation ovarienne
- Chimique, en utilisant les agonistes de la LH-RH (luteinizing hormone-releasing hormone)
- Le deuxième type repose sur les inhibiteurs compétitifs de la liaison des œstrogènes sur leurs récepteurs :
- Les SERM (Selective Estrogen Receptor Modulator), comme le tamoxifène, découvert en 1975, se fixent au récepteur des œstrogènes, induisant une modification de sa conformation
- Les SERD (Selective Estrogen Receptor Degradation ), comme le fulvestrant (Faslodex™) découvert en 1995, provoquent une dégradation des récepteurs aux œstrogènes
- Le troisième type est constitué par les inhibiteurs de l’aromatase, découverts en 1981, qui inhibent l’aromatisation des androgènes en œstrogènes et dont il existe deux types, non stéroïdiens, de type 1 et stéroïdiens, de type 2
L'efficacité indiscutable de l'hormothérapie....
| Groupes étudiés | Réduction relative du risque de rechute* | Réduction relative du risque de décès |
|---|---|---|
| Tamoxifène 1-2 ans | 26 % | 28 % |
| Tamoxifène 5 ans | 40 % | 25 % |
| Sans chimiothérapie | 35 % | 22 % |
| Avec chimiothérapie | 35 % | 30 % |
| Pas de ganglion (N0) | 43 % | 22 % |
| Ganglions (N+) | 37 % | 26 % |
* La Réduction Relative de Risque (en anglais: Relative Risk Reduction = RRR) est une valeur relative de diminution du risque. C'est le rapport entre la différence de risque entre le groupe traité et le groupe témoin (placebo) d'une part et le risque dans le groupe témoin (placebo) d'autre part.
L’hormonothérapie préventive
Des essais comparatifs de traitement préventifs du cancer du sein par tamoxifène ou raloxifène pendant 5 ans chez des patientes présentant un risque élevé de cancers de développer la maladie (contexte familial, antécédents d'intervention pour hyperplasie atypique, néoplasie lobulaire in situ, ou cancer canalaire in situ) ont montré une diminution relative de l'ordre de 40 à 50 % du taux d'apparition de cancers invasifs à 5 ans et 10 ans de recul chez les patientes traitées.
Soulignons, qu’à ce jour, en France, ni le tamoxifène ni le raloxifène n'ont d'autorisation de mise sur le marché dans cette indication.
Les médicaments anti-oestrogéniques
LEUR MODE D’ACTION
Un anti-estrogène est un médicament qui s’oppose aux effets biologiques des œstrogènes. C’est un effet anti-hormonal. Il n’empêche pas la production d’œstrogènes, mais il bloque les récepteurs des œstrogènes et donc l’action des œstrogènes au niveau des cellules et en particulier les cellules cancéreuses porteuses du récepteur œstrogène.
SERM OU ANTI-ESTROGENES
Antérieurement connus sous le nom d’anti-estrogènes pour leur activité antagoniste des récepteurs aux œstrogènes du tissu mammaire, les SERM ou Specific Estrogen-Receptor Modulators sont des molécules de synthèse non stéroïdiennes capables de se fixer de façon sélective aux récepteurs aux œstrogènes (ERα, ERβ), d’en moduler la réponse et d’exercer un effet agoniste ou antagoniste en fonction du tissu considéré. Deux molécules sont commercialisées pour le traitement du cancer du sein et actives par voie orale en une seule prise par jour :
- Le tamoxifène (Nolvadex™ et génériques) dont la dose standard est d’un comprimé à 20 mg par jour en général pour 5 ans
- Le torémifène (Fareston™) dont la dose standard est d’un comprimé à 60 mg par jour
Le tamoxifène est utilisé depuis 25 ans dans le traitement des cancers du sein, à la fois dans les formes avancées et comme traitement adjuvant. Ce médicament augmente le taux de guérison des femmes qui ont été traitées pour un cancer du sein avec récepteurs aux œstrogènes (ER+). Il réduit aussi le risque d'apparition du cancer dans l'autre sein.
En traitement adjuvant, après une intervention pour un cancer du sein, il est recommandé de prendre ce type de médicaments, tous les jours pendant 5 ans.
SERD (SELECTIVE ESTROGEN RECEPTOR DOWNREGULATORS)
Ces médicaments se lient au récepteur œstrogène et induisent leur involution (down-régulation) rapide de ces derniers. Ils n'ont aucune activité agoniste dans aucun tissu.
Fulvestrant (Faslodex™)
C'est un médicament injectable. La dose recommandée est une injection de 250 mg une fois par mois.
Il est homologué pour le traitement du cancer du sein, localement avancé ou métastasé, chez la femme ménopausée possédant des récepteurs aux œstrogènes positifs, en cas de récidive pendant ou après un traitement adjuvant par un antiestrogène ou de progression de la maladie sous traitement.
Elacestrant (Orserdu™)
C'est un antagoniste sélectif du récepteur α aux estrogènes (ERα) qui provoque une dégradation du récepteur, actif par voie orale.
Il est indiqué, en monothérapie, pour le traitement des femmes ménopausées et des hommes atteints d’un cancer du sein localement avancé ou métastatique, positif pour les récepteurs aux estrogènes (RE), HER2-négatif, avec mutation activatrice du gène ESR1, en progression après au moins une ligne d’hormonothérapie en association avec un inhibiteur de CDK 4/6.
La dose recommandée est de 345 mg une fois par jour. Le traitement doit être poursuivi tant qu’un bénéfice clinique est observé ou jusqu’à la survenue d’une toxicité inacceptable.
LES EFFETS SECONDAIRES DE CES MÉDICAMENTS
Ils résultent principalement de son action agoniste œstrogénique sur certaines cibles. Ce sont :
- Des bouffées de chaleurs,
- Des nausées, des douleurs de l’estomac (épigastralgies),
- Un risque accru de phlébites et beaucoup plus rarement de thromboses artérielles
- De pertes vaginales (leucorrhées) par augmentation (hyperplasie) de la muqueuse vaginale,
- Une augmentation du risque de cancer de l'endomètre (cancer du corps de l’utérus) qui évolue avec la durée du traitement. ce qui implique une surveillance attentive
Ceci explique pourquoi une surveillance du traitement s’impose. Le bilan de suivi habituel comprend :
- Un examen gynécologique complet, avant le début du traitement, à la recherche d'une anomalie de l’utérus et ensuite annuellement
- Un examen approfondi, en urgence, devant tout saignement
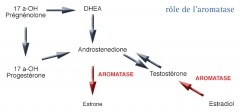
L’aromatase
SON RÔLE
C’est une enzyme, la 19-hydroxylase que l'on retrouve dans les ovaires et les glandes surrénales.
Elle est impliquée dans la production d'œstrogènes qui sont des hormones féminisantes. Ces hormones sont synthétisées à partir d'androgènes qui sont des hormones masculinisantes. Il s’agit principalement de la testostérone et de l'androstène-dione. La synthèse aboutit principalement à la production d'œstradiol et d'œstrone.
De plus, cette enzyme assure la conversion du cholestérol et des androgènes en œstrogènes au niveau de la glande surrénale et des tissus graisseux périphériques. Enfin, certaines cellules tumorales sont capables d'activer la synthèse de l'aromatase.
SA RÉPARTITION
L'enzyme aromatase est présente en grandes quantités dans le placenta et dans les ovaires avant la ménopause. Elle est aussi retrouvée, en plus faibles quantités, dans les muscles, le cerveau, le tissu graisseux et le sein.
EN CAS DE CANCER DU SEIN
Les tumeurs cancéreuses du sein contiennent aussi cette enzyme ce qui explique pourquoi elle occupe une position clé dans le traitement hormonal de ces cancers. Les médicaments inhibiteurs de l'aromatase vont tendre à freiner voire supprimer la production d'œstrogènes.
LES INHIBITEURS DE L'AROMATASE
LEUR MODE D'ACTION
Ces médicaments bloquent la production des œstrogènes au niveau des tissus périphériques et tumoraux. En bloquant l'activité de cette enzyme, ils jouent donc un rôle important dans le contrôle de la régulation de la croissance tumorale œstrogène-dépendante.
Cette classe d’hormones est réservée à la femme ménopausée car elle ne bloque pas, voire augmente l'activité ovarienne.
LES MEMBRES DE CETTE FAMILLE
Les inhibiteurs stéroïdiens de première génération : l'aminoglutéhimide (Femara™)
C'est un inhibiteur de structure chimique « non-stéroïdienne ». Ce médicament fut, à l’origine, développé comme antiépileptique, mais les essais cliniques durent être arrêtés, en raison de cas d’insuffisance surrénalienne.
Ce médicament est efficace dans le traitement de certains cancers du sein. Il est indiqué pour le traitement des cancers du sein hormonodépendants métastasés post ménopausiques, en particulier avec récepteurs estrogéniques positifs. dans cette indication, la posologie varie de 500 à 1 000 mg par jour répartis en 3 ou 4 prises.
Il est cependant moins utilisé car il possède aussi une action sur les hormones surrénaliennes qui nécessite la prescription d'un traitement substitutif pour prévenir l'insuffisance surrénalienne.
Les inhibiteurs de seconde génération : le formestane (Lantéron™)
Un seul médicament de structure stéroïdienne est disponible. Il est indiqué pour le traitement du cancer du sein à un stade avancé chez la femme ménopausée, après échec ou intolérance au tamoxifène.
Ce médicament est actif par voie injectable intramusculaire à la dose de 250 mg tous les 15 jours.
Les inhibiteurs de troisième génération
Ils ont été mis au point dans les années 1990. Trois molécules sont commercialisés en France. Tous ces médicaments sont prescrits à raison d’un seul comprimé une fois par jour.
- Les médicaments de structure non-stéroïdienne, de type 1, dérivés de l'aminoglutéthimide, sont l’anastrozole (Arimidex™) et le létrozole (Femara™) et leurs génériques.
- Le médicament de structure stéroïdienne, de type 2, dérivés de l'andostène-dione, est représenté par l’exémestane (Aromasine™) et ses génériques.
Les grands essais démontrant l'efficacité des inhibiteurs de l'aromatase...
Essais en seconde ligne versus mégestrol (Megace™)
Anastrozole versus acétate de mégestrol A.U. Buzdar et al. 1998 : pas de différence en temps jusqu’à progression mais amélioration de la survie
Létrozole versus acétate de mégestrol A.U. Buzdar et al. 2001 & P. Dombernowsky et al. 1998 : pas de différence ni en temps sans progression ni en termes de survie
Exémestane versus acétate de mégestrol M. Kaufman et al. 2000 : amélioration du temps sans progression et de la survie
Essais en première ligne métastatique comparant inhibiteurs de l’aromatase au tamoxifène
Anastrozole versus tamoxifène J.M. Nabholtz et al. 2000 : augmentation du temps jusqu’à progression (90 % des tumeurs RH+)
Anastrozole versus tamoxifène (TARGET) J. Bonneterre et al. 2001 : pas de différence en temps jusqu’à progression (45 % des tumeurs RH+)
Létrozole versus tamoxifène H. Mouridsen et al. 2003 : augmentation du temps jusqu’à progression mais pas de différence en survie
Exémestane versus tamoxifène R.J.Paridaens et al. 2008 : survie sans progression et survie globale similaires
Essais en situation adjuvante
ATAC : anastrozole versus tamoxifène : diminution du risque de rechute de 13 % par rapport au tamoxifènes
BIG 01-98: letrozole versus tamoxifène : diminution du risque de rechute de 19 % par rapport au tamoxifène
IES examestane versus tamoxifène (en séquentiel) : diminution du risque de rechute de 24 % par rapport au tamoxifène
ITA anastrozole versus tamoxifène (en séquentiel) : diminution du risque de rechute de 65 % par rapport au tamoxifène
Les indications des inhibiteurs de l'aromatase dans le traitement des cancers du sein
EN CAS DE CANCERS DU SEIN AVANCES EN PREMIERE ET SECONDE LIGNE
Cette classe de médicaments cible les patientes ménopausées présentant un cancer du sein exprimant le récepteur œstrogène « ER+ ». Les modalités d’utilisation de ces trois médicaments sont variables, même s’ils possèdent un mode d’action identique.
- L’anastrozole (Arimidex™) en traitement de première ligne
- Le létrozole (Fémara™) en traitement de première ligne et en relais après 5 ans de Tamoxifène
- L’exemestane (Aromasine™) en « switch » après 2 à 3 ans de Tamoxifène, ou d’emblée en association aux analogues de la LHRH pour les femmes non ménopausées à haut risque de rechute.
EN TRAITEMENT ADJUVANT DES FORMES LOCALISEES OU LOCALEMENT AVANCEES DE LA MALADIE
L’étude ATAC (anastrozole versus tamoxifène)
Cet essai a inclus 9 366 femmes : 3 125 ont reçu 1 mg d’anastrozole pendant 5 ans, 3 116 ont reçu 20 mg de tamoxifène et 3 125 l’association des deux.
- Les survies sans rechute à 4 ans sont de 86,9 et 84,5 %, respectivement dans le groupe anastrozole et tamoxifène (Réduction du risque relatif (RRR) de 14 % ; intervalle de confiance à 95 % [IC] = 1 à 24% ; p = 0,03). Le bénéfice est plus marqué dans la population avec récepteurs hormonaux positifs (Réduction relative du risque de rechute 18 % ; IC 95 % = 4 à 30% ; p = 0,014).
- La diminution d’incidence du cancer du sein controlatéral est également en faveur de l’anastrozole (RRR de 38 % ; IC 95 % = -62 % à + 2 % 0,38-1,02 ; p = 0,062) ; il est statistiquement significatif dans le groupe avec récepteurs hormonaux positifs (RRR de 44 % ; IC 95 % = 0,32-0,98 ; p = 0,042).
Les données concernant les effets secondaires confirment une réduction, par rapport au tamoxifène, des cancers de l’endomètre (p = 0,007), des leucorrhées et saignements vaginaux (p < 0,001 pour les deux), des accidents cérébraux (p < 0,001), des accidents thromboemboliques (p < 0,001), et des bouffées de chaleur (p < 0,001) dans le bras anastrozole, alors que les troubles musculosquelettiques et les fractures (p < 0,001 pour les deux) sont moins fréquents dans le bras tamoxifène.
L’essai IES (remplacement par l'examestane du tamoxifène après 2 ou 3 ans de traitement par ce médicament)
Cette étude avait pour but de définir si, après 2 à 3 ans, remplacer le tamoxifène par l’exemestane était plus efficace que de continuer le tamoxifène pour la durée restante du traitement, au total 5 ans.
Les 4 742 femmes traitées pour un carcinome infiltrant du sein avec récepteurs d’œstradiol positifs ou inconnus pouvaient être incluses dans l’essai au cours de leur troisième année de tamoxifène adjuvant. Elles étaient randomisées entre exemestane ou tamoxifène pour le reste des 5 ans. Au moment de la randomisation, la majorité (97 %) recevait 20 mg de tamoxifène, mais celles qui recevaient 30 mg étaient éligibles. Avec un recul médian de 30,6 mois, la seconde analyse intermédiaire dénombre
- 449 événements (rechute locale ou métastatique, cancer controlatéral ou décès) : 183 dans le groupe exemestane et 266 dans le groupe tamoxifène. La diminution du risque relatif d'événement est de 32 % en faveur de l’exemestane (p = 0,00005), ce qui se traduit par un bénéfice absolu de 4,7 % de survie sans récidive à 3 ans après la randomisation.
- Les décès étaient au nombre de 93 dans le groupe exemestane et de 106 dans le groupe tamoxifène. Les courbes de survie ne diffèrent pas de façon significative.
Les cancers controlatéraux étaient moins fréquents sous exemestane (9 contre 20 ; p = 0,038).
Les effets secondaires observés dans le groupe exemestane étaient des arthralgies 5,4 % et des diarrhées 4,3 %.
Le tamoxifène était associé à des symptômes gynécologiques (9,0 %), des saignements vaginaux (5,6 %), des crampes musculaires (4,4 %) et des accidents thromboemboliques (2,4 %).
Les fractures sont retrouvées plus fréquemment avec l’exemestane (3,1 contre 2,3 % ; p = 0,08).
Onze cancers de l’endomètre ont été observés chez les femmes qui poursuivaient le tamoxifène et 5 chez celles qui prenaient l’exemestane.
L’essai MA17 (remplacement après 5 ans de tamoxifène par le létrozole)
L'objectif de l'essai était d'étudier l’effet de 5 ans de létrozole chez la femme ménopausée traitée par tamoxifène adjuvant pour un cancer du sein curable pendant 5 ans. Après 4,5 à 6 ans de tamoxifène ou dans les 3 mois qui suivaient, les femmes pouvaient être incluses dans l’essai pour recevoir du letrozole ou un placebo pour une durée de 5 ans.
Un total de 5 187 femmes ont été incluses avec un recul médian de 2,4 ans. La première analyse intermédiaire montrait
- 207 rechutes locales ou métastatiques du cancer du sein ou controlatéral : 75 dans le groupe letrozole et 132 dans le groupe placebo.
- Les probabilités de survie sans rechute à 4 ans étaient respectivement de 93 et 87 % (p ≤ 0,001).
- Les décès étaient au nombre de 31 dans le groupe letrozole et de 42 dans le groupe placebo. Les courbes de survie ne différaient pas de façon significative.
Au vu des résultats de cette analyse intermédiaire, un comité indépendant a recommandé l’arrêt de l’essai et une rapide communication des résultats aux participantes.
Les effets secondaires observés dans le groupe létrozole étaient : bouffées de chaleur, arthralgies, myalgies et arthrites. Les saignements vaginaux étaient moins fréquents dans le groupe letrozole.
Le diagnostic d’ostéoporose a été porté chez 5,8 % des femmes du groupe letrozole et 4,5 % des femmes du groupe placebo (p = 0,07). Les fractures sont retrouvées dans 3,6 et 2,9 % des cas (p = 0,24).
LES EFFETS INDÉSIRABLES DES ANTI-AROMATASES
POUR L'ENSEMBLE DE CETTE CLASSE THERAPEUTIQUE
Les inhibiteurs de l’aromatase de 2ème et 3ème générations ont moins d’effets indésirables que le tamoxifène. Les principaux effets secondaires parfois rencontrés sont :
- Des bouffées de chaleur,
- Une perte osseuse avec augmentation du risque de fractures
- Des douleurs articulaires et musculaires touchant notamment les poignets et les coudes entrainant parfois un arrêt de traitement et une augmentation du risque de syndromes du canal carpien
- Une prise de poids,
- Une diminution de la libido,, de la sécheresse vaginale avec dyspareunie (douleurs lors des rapports sexuels)
LE RISQUE DE FRACTURES OSSEUSES
Ce que l'on sait...
Par rapport au tamoxifène, il existe un risque accru de décalcification osseuse ou ostéoporose et de fracture. De ce fait, la surveillance du traitement impliquera de pratiquer une ostéodensitométrie qui est la technique de référence pour mesurer la densité osseuse (DMO).
Son résultat est exprimé par le T-score, écart entre la densité osseuse mesurée et la densité osseuse théorique de l’adulte jeune de même sexe, au même site osseux (rachis lombaire, extrémité supérieure du fémur ou poignet).
- Densité osseuse normale : T-score > - 1
- Ostéopénie : - 2,5 < T-score ≤ - 1
- Ostéoporose (dite sévère en cas de fracture) : T-score ≤ - 2,5 :
Les recommandations
Les sociétés savantes recommandent, que le risque de fractures osseuses soit évalué systématiquement par une ostéodensitométrie. Un traitement pour prévenir les fractures sera institué durant la durée du traitement si
- T score est <-2 SD ou à T <-1,5 SD s’il existe un facteur de risque supplémentaire de fragilité osseuse
- Il existe plus de deux facteurs de risque en l’absence de mesure de la densité osseuse
- Si le score T > −1, 5 SD et aucun facteur de risque, un traitement pourra être décidé sur la base de la perte de osseuse durant la première année
Un suivi de la masse osseuse sera institué 12 à 24 mois après la fin du traitement par anti-aromatase.
Leur prévention
En dehors de la pratique d’une activité physique, d’une supplémentation en vitamine D, il consiste en la prescription soit d’un traitement par un bisphosphonate (zolédronate 4 mg en intraveineux tous les 6 mois ou Actonel™, Bonviva™ Fosamax™ et les génériques ) soit par le dénosumab Prolia™ (60 mg par voie sous-cutanée tous les 6 mois).
En résumé, les indications officielles des inhibiteurs de l'aromatase pour les femmes ménopausées
|
Indications |
Arimidex™ |
Aromasine™ |
Fémara™ |
|---|---|---|---|
|
Maladie avancée |
1ère ligne |
1ère ligne |
1ère ligne |
|
Adjuvant |
1ère intention |
Après 2 ou 3 ans de tamoxifène |
1ère intention |
|
Néoadjuvant |
Non |
Non |
Oui |
Faut-il poursuivre l’hormonothérapie au-delà de 5 ans ?
POUR LE TAMOXIFENE
La poursuite du tamoxifène au-delà de 5 ans a été étudiée soit par des deuxièmes randomisations dans des essais qui posaient initialement une autre question, soit dans des essais spécifiques.
La seconde randomisation de l’essai NSABP B14 (J Natl Cancer Inst. 2001;93:684)
Elle concernait 1172 femmes qui avaient reçu 5 ans de tamoxifène et étaient indemnes de rechute au terme du traitement. Parmi elles, 593 ont poursuivi le traitement et 579 ont reçu un placebo.
- Quatre ans après la seconde randomisation, un avantage sur la survie sans rechute (92 % contre 86 %) et sur la survie globale (96 % contre 90 %) était détecté en faveur des femmes qui avaient arrêté le tamoxifène.
- Sept ans après la seconde randomisation, un petit avantage en survie sans rechute (82 % contre 78 %) et en survie globale (94 % contre 92 %) était retrouvé chez les femmes qui avaient interrompu le tamoxifène.
La seconde randomisation de l’essai écossais
Elle ne concernait que 342 femmes, 169 ont interrompu le tamoxifène et 173 ont poursuivi le traitement. L’analyse de cette seconde partie de l’essai ne retrouvait aucun bénéfice à la poursuite du tamoxifène.
Les deux essais retrouvaient une augmentation des cancers de l’endomètre liée à la poursuite du tamoxifène.
L’essai TAM01 : 3 ans versus 10 ans...
Il comparait un traitement de 3 ans à un prolongement pour 10 années supplémentaires. Les résultats indiquent l'utilité de poursuivre le tamoxifène jusqu’à 5 ans.
L'essai ATTOM (Adjuvant Tamoxifen - To Offer More?).
Les bénéfices en termes de récidive et de mortalité d'un allongement à dix ans de la durée du traitement par tamoxifène en adjuvant du cancer du sein avec expression des récepteurs aux estrogènes (ER+) ont été confirmés cette année par
Dans l'étude ATLAS (Adjuvant Tamoxifen - Longer Against Shorter), The Lancet, mars 2013, 381(9869):805-16
La différence entre les deux bras s'est révélée significative au cours de la deuxième décennie après le diagnostic, le risque de récidive et le risque de décéder d'un cancer du sein chutant respectivement de 25 % et de 29 %, chez les femmes qui ont poursuivi le tamoxifène, par rapport à celles dont le traitement a été stoppé à cinq ans.
La méta-analyse de l’EBCTCG (The Lancet, 366: 2087-2106, 2005)
Elle a porté sur 196 essais comportant ou pas de chimiothérapie. Chez les patientes RH+ve, après 5 ans de tamoxifène, à 15 ans :
- Le taux de récidives est de 33 % contre 45,6% dans groupe non traité ce qui correspond à un gain net à 15 ans de 11,8 ± 1,3 % (p<0.0001)
- Un nombre plus élevé de patientes en vie de 74,4 % contre 65,2 % dans le groupe non traité ce qui équivaut à un gain net, à 15 ans, de 9,2 ± 1,2% (p < 0.00001)
LES INHIBITEURS DE L'AROMATASE
L’essai MA 17 (New England Journal of Medicine 2003;349:1793-1802)
Il a été réalisé pour étudier l’effet de 5 ans de létrozole après 5 ans de tamoxifène en traitement adjuvant. Il a été le premier à montrer une réduction des rechutes avec la poursuite d’une hormonothérapie au-delà de 5 ans.
Il s’agit d’un changement d’hormonothérapie et non de la poursuite du même traitement, l’hormonothérapie initiale était le tamoxifène et non pas un inhibiteur de l’aromatase.
L'étude de Austrian Breast and Colorectal Cancer Study Group (N Engl J Med 2021; 385:395-405)
Cette étude a inclus 3484 femmes ménopausées porteuses d'un cancer du sein exprimant les récepteurs hormonaux et traité pendant 5 ans par un inhibiteur de l'aromatase (anastrozole).
La continuation du traitement pendant deux ans est équivalente à une utilisation sur 10 ans mais est mieux tolérée (moins de fracture des os).
Les effets secondaires possibles des différentes homonothérapies...
- Prise de poids (traitement progestatif)
- Bouffées vasomotrices (anti-estrogènes, anti-aromatases)
- Diminution de la trophicité de la muqueuse vaginale (anti-aromatases)
- Douleurs osseuses et articulaires, syndrome du canal carpien (anti-aromatases)
Mise à jour
16 mai 2024

