Bilan préthérapeutique
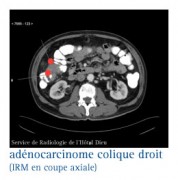
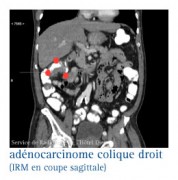
LES RÉPONSES À APPORTER LORS DE LA RÉUNION DE CONCERTATION PLURIDISCIPLINAIRE..
LE RATIONNEL
Le bilan d'extension à pour objectif de répondre précisément aux questions suivantes qui conditionnent la stratégie thérapeutique. :
- La tumeur est-elle opérable ou non ?
- Le patient est-il en état de recevoir le ou les traitements envisagés ?
- La maladie a-t-elle déjà diffusé à distance ?
- Y-a-t-il une justification à mettre en œuvre un traitement préopératoire néoadjuvant ?
LES MOYENS
Dans le cas général
Les sites où siègent le plus fréquemment les métastases font l'objet d'une exploration systématique :
- Le foie par l’échographie, voire le scanner
- Le poumon, surtout pour en cas de localisation rectale, par une radiographie pulmonaire ; en cas de doute, un scanner thoracique
- Les ganglions sus-claviculaire gauche, à l'examen clinique, car palpables
- Au cas par cas, tout autre examen induit par la symptomatologie
La TEP-FDG
Ce n’est pas un examen systématique dans le bilan initial préthérapeutique ou la surveillance du cancer colorectal.
Elle peut vous êtes proposée en cas de métastase hépatique résécable afin d’exclure d’autres sites métastatiques.
Cet examen est maintenant recommandé en cas de suspicion d'une récidive locale ou métastatique, pour caractériser des anomalies morphologiques ou en cas d’élévation du marqueur tumoral, ACE.
Dans le cas d'un cancer du rectum
Si une évaluation d'une atteinte locorégionale est nécessaire, l’IRM pelvienne est l'examen de choix.
En cas d'une petite tumeur, une échographie endorectale sera l'examen le plus utile.
Une TEP-FDG peut être proposée pour la planification de la radiothérapie des cancers du rectum.
@ Pour en savoir plus : IMAGERIE MÉDICALE
Les examens habituels
- Vérifier que le foie n’est pas touché : scanner du foie ou échographie hépatique
- S’assurer qu’il n’y a pas de dissémination dans le thorax (poumons, médiastin, plèvre, paroi) : radio du poumon, scanner thoracique
- Confirmer l’absence d’extension aux os : scintigraphie osseuse
- Vérifier, par un scanner/IRM du rachis une zone suspecte
Les marqueurs de biologie moléculaire
Le statut RAS
Il est défini par la recherche de mutations KRAS ou NRAS (habituellement exclusives) . Ces gènes codent pour de petites protéines impliquées dans la transduction du signal mitotique au niveau cellulaire, en aval de l’activation du récepteur membranaire à l’ Epithelial Growth Factor Receptor (EGFR). En cas de mutation activatrice RAS, le blocage du récepteur à l’EGF par des thérapies ciblées anti-EGFR (cetuximab ou panitumumab) est inefficace, les voies de transduction restant alors actives.
A l'opposé, l’absence de mutation KRAS ou NRAS permet un traitement (par le cetuximab ou le panitumumab. Néanmoins, 60 % des patients, sans mutation KRAS ou NRAS pourront bénéficier d’une thérapie anti-EGFR et seuls 40 à 60 % répondront à la thérapie anti-EGFR.
Le statut BRAF
Il est déterminé par la recherche d’une mutation BRAF V600E. Il permet l’utilisation d’un anti-BRAF (encorafenib). La mutation BRAFV600E a une valeur de mauvais pronostic.
Les autres biomarqueurs moléculaires pouvant être recherchés:
Un gène de fusion NTRK n’est retrouvé que dans moins de 1 % des cas et serait un peu plus fréquent chez les patients microsatellites instables dMMR (5 %) que microsatellites stables pMMR (0,4 %). Dans ce cas, les patients sont éligibles à une thérapie ciblée par le larotrectinib, inhibiteur sélectif des protéines de fusion TRK.
Des mutations de POLE ou POLD1 sont présentes dans 1 à 3 % des adénocarcinomes coliques. Ces tumeurs sont très sensibles à l’immunothérapie par blocage des checkpoints inhibiteurs.
Une amplification de HER2 pour les tumeurs RAS non mutées est mise en évidence dans 3 à 5 % des cas. En cas d’amplification, une thérapie par un anti-HER2 peut être proposée.
Des mutations PI3CA sont présentes dans 15 à 20 % des cancers coliques Leur présence pourrait justifier de thérapies adjuvantes à base d’aspirine, avec un meilleur pronostic et moins de récidive chez les patients ayant été opérés d’un adénocarcinome PI3CA muté ;
Le récepteur c-MET est un récepteur tyrosine kinase. Les gains mutationnels ou la mutation de l’exon 14 du gène c-MET sont rares mais peuvent être éligibles à des thérapies inhibitrices c-Met.
Actuellement, les experts s'accordent pour recommander de déterminer :
- Le statut du gène RAS tumoral (KRAS et NRAS) : muté ou "sauvage - non muté"
- Le statut du gène BRAF tumoral : muté ou "sauvage"
- La détermination du phénotype MSI afin de pouvoir, si nécessaire, proposer une immunothérapie (anti-PD1et anti-PDL1) pour les cancers colorectaux métastatiques et dans le cadre de la recherche d’un syndrome de Lynch.
Mise à jour
20 janvier 2024

