Modes d'action
La « machinerie » cellulaire…
LA RECHERCHE FONDAMENTALE
Les scientifiques ont mis en évidence l’existence de nombreux processus de transmission de signaux entre les cellules allant de « l'ordre de se multiplier » à celui de « se suicider », en passant par l'homéostasie quand aucune multiplication cellulaire n'est pertinente au regard de l'homéostasie.
Parallèlement, on s'est aperçu qu'au cours des cancers, ces mécanismes sophistiqués de régulation de la croissance tumorale étaient déréglés et qu'un certain nombre de récepteurs étaient soit en trop grand nombre (surexprimés), soit suractivés, soit encore que les molécules qui transmettent le signal étaient anormales et transmettaient un signal permanent de multiplication ou au contraire ne transmettaient pas un signal de mort cellulaire.
LA RECHERCHE TRANSLATIONNELLE
A partir des données obtenues par la recherche fondamentale sur ces mécanismes, elle a permis la mise au point de nouveaux médicaments qui ont, déjà, profondément renouveler et améliorer le traitement du cancer.
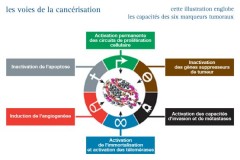
"THE HALLMARKS OF CANCER"
Dans un article publié dans la revue "Cells", il y a 20 ans, dont le titre est "The hallmarks of cancer"", que l’on peut traduire par "les capacités spécifique des cancers", D. Hanahan et R. Weinberg montrent que les cancers acquièrent six capacités distinctives que sont :
- L’autosuffisance en signaux de croissance,
- L’insensibilité aux signaux inhibiteurs de la croissance,
- La capacité à éviter l’apoptose,
- La capacité de se répliquer indéfiniment,
- L’induction de l’angiogenèse
- La capacité à former des métastases.
En 2011, dans un article "Hallmarks of cancer : The next generation ", révisé en 2017, ces mêmes auteurs mettent aussi en évidence deux caractéristiques favorisant les cancers, mais qui ne sont pas qualifiées de capacités distinctives : l’inflammation favorisant les tumeurs et l’instabilité et mutations du génome.
Grace à la découverte des oncogènes et des gènes suppresseurs de tumeurs, aux progrès de la biologie moléculaire et aux concepts développés par Hanahan et Weinberg, le cancer apparaît comme une maladie de la signalisation.
De fait, la tumeur possède un génome original qui s’exprime au niveau structural par analyse des gènes à travers : mutations, délétions, amplification ou translocation et au niveau fonctionnel par l’analyse des transcrits à travers une surexpression ou, à l'inverse une sous-expression. La tumeur possède un génome original qui s’exprime :
- Au niveau structural par analyse des gènes à travers :
- Mutations
- Délétions
- Amplification
- Translocation
- Au niveau fonctionnel par l’analyse des transcrits à travers :
- Surexpression
- Sous-expression
Les 4 objectifs principaux des biothérapies...
- Arrêter la croissance des cellules cancéreuses
- "Affamer" la tumeur en l’empêchant de détourner le système sanguin à ses fins en s’opposant à la formation des nouveaux vaisseaux qui contribuent à sa croissance (angiogenèse).
- Diriger une réaction immunitaire contre les cellules cancéreuses
- Commander la mort de la cellule cancéreuse, en stimulant l’apoptose, mort naturelle de la cellule (disparition de cette faculté chez la cellule tumorale qui devient "immortelle" et ne cesse de se diviser
Des progrès déterminants depuis plus de 20 ans !
LA FILIATION....
La grande majorité des médicaments de chimiothérapie traditionnelle a été conçue pour bloquer la multiplication cellulaire en s’attaquant à l’ADN de la cellule ou au fuseau mitotique nécessaire à la division cellulaire. L’inconvénient de cette approche est la relative non-spécificité des médicaments qui ne peuvent épargner les cellules saines. Il s’ensuit des effets secondaires, comme, par exemple, la perte des cheveux, les troubles digestifs, nausées, vomissements, diarrhées, mucite ou une toxicité pour la moelle osseuse.
Les découvertes de biologie moléculaire, suscitées par le "Projet Cancer" initié au début des années 1970 par le président des États-Unis, Richard Nixon, ont débouché sur de nouveaux outils thérapeutiques n'utilisant plus l'atteinte cytotoxique, comme moyen de guérir le malade, mais plutôt l’utilisation d’un frein pour ralentir ou arrêter le développement des métastases, n'entraînant pas obligatoirement la mort des cellules cancéreuses mais réduisant considérablement leur potentiel délétère.
UNE DÉFINITION PARMI D'AUTRES DES THERAPIES "CIBLEES"
Les thérapies ciblées (targeted therapies) constituent un groupe de médicaments relativement récents qui interviennent de manière sélective dans certains processus cellulaires tumoraux. Ces médicaments bloquent la croissance de la tumeur ou en ralentissent le métabolisme.
Ils exploitent des caractéristiques particulières à l’intérieur ou à la surface des cellules cancéreuses qu’ils utilisent comme points d’attaque (targets) ; en conséquence, ils ne sont efficaces que si ces caractéristiques sont présentes dans les cellules cancéreuses de la personne traitée.
LA TRANSDUCTION DU SIGNAL (SYSTEME D'AMPLIFICATION INTRA-CELLULAIRE)
Elle est initiée par l'interaction d'une molécule extracellulaire (ligand)qui va secondairement activer un récepteur membranaire de la cellule. De cette activation, va naître une modification des molécules intracellulaires, entraînant secondairement une réponse de la cellule. Il s’en suit une cascade de signaux à l’intérieur de la cellule.
À chaque étape de la cascade, le signal est amplifié et, de ce fait, un signal très faible peut provoquer une réponse importante. Le signal, in fine, va entraîner des modifications cellulaires soit au niveau de l’ADN, soit dans l’activité des enzymes du cytoplasme de la cellule.
Cette cascade d’événements va conduire à l’activation intracellulaire du gène Ras (Retrovirus Associated Sequences) qui est un oncogène.
LES OPTIONS VALIDÉES
La grande majorité des thérapies ciblées intervient à un ou à plusieurs des « étages » de la transduction du signal. Pour interférer avec ces processus, plusieurs stratégies sont possibles qui ont été confirmées dans le traitement de nombreux types de cancers :
- Bloquer les ligands des récepteurs membranaires grâce un anticorps monoclonal
- Bloquer les récepteurs membranaires par un anticorps monoclonal
- Empêcher l’activation des récepteurs membranaires à activité tyrosine kinase (enzyme impliquée dans la phosphorylation des protéines). C'est une importante famille de récepteurs membranaires impliqués dans de nombreux processus cellulaires dont il existe 18 familles chez les vertébrés
- Bloquer la cascade de transduction par les inhibiteurs de tyrosine kinase, les molécules agissant sur la voie PI3K/PTEN/AKT/mTOR et les inhibiteur du ras.
Dix propriétés ou potentialités, retrouvées dans tous les cancers et impliquées dans le développemen
|
Dérèglements et addictions |
Thérapie ciblée |
|---|---|
|
Prolifération hors contrôle due à une addiction aux facteurs de croissance |
Anti-EGFR |
|
Dérèglement du métabolisme énergétique |
Inhibiteurs de la glycolyse aérobique |
|
Résistance aux signaux de mort (apoptose) |
Pro-apoptotiques ; BH3 mimétiques, inhibiteurs bcl2 |
|
Instabilité génomique et mutation |
Inhibiteurs de PARP (PARPi) |
|
Angiogenèse |
Inhibiteurs du VEGF |
|
Activateurs de l'invasion et des métastases |
Inhibiteurs du HGF/c-Met |
|
Inflammation tumorale |
Anti-inflammatoires sélectifs |
|
Immortalisation |
Inhibiteurs des télomérases |
|
Échappement à la surveillance immunologique |
Anti-CTLA4, anti-PD1, anti-PDL1 |
|
Résistance aux signaux antiprolifératifs |
Inhibiteur des kinases cycline-dépendantes (cdk) |
Pour quelles cibles ?
LES ANOMALIES DES GENES
Il s’agit, le plus souvent d’altérations de gènes qui sont à l’origine de la production de protéines anormales responsables du phénotype « cancéreux ». Ces protéines sont dites oncogéniques. Deux types d’anomalies, mutuellement non exclusives, peuvent être alors observées :
- La production d’une protéine oncogénique hyperactive de façon inappropriée ou surexprimée et amplifiant la production de cellules cancéreuses. Les cellules cancéreuses deviennent addictes au ligand. C'est le phénomène de l'addiction oncogénique.
Une fois bloquée, cette voie, les cellules tumorales arrêtent leur prolifération. - La perte de fonction d’un gène suppresseur de tumeur ou « anti-oncogène. Dans ce cas, à ce jour, on ne sait pas encore réactiver le gène suppresseur
LES MOYENS
La fixation d’un ligand (molécule qui se lie de manière réversible sur une macromolécule cible, protéine ou acide nucléique) sur son récepteur transmembranaire entraîne une cascade d’activation par phosphorylation de protéines partenaires, permettant la transcription de gènes cibles. C’est la transduction du signal. Il s’agit d’un processus universel, dont la dérégulation contribue souvent à la cancérogenèse.
LES "CIBLES" ACTUELLES
Les thérapies ciblées visent soit à bloquer la signalisation au niveau extracellulaire des récepteurs de la cellule, soit à stopper la signalisation intracellulaire du récepteur, ou au niveau de protéines intracellulaires intermédiaires impliquées dans la cascade de signalisation.
- Les voies de signalisation intracellulaires, récepteurs membranaires ou acteurs intracellulaires les anticorps monoclonaux, médicaments en « mab » ou les petites molécules intracytoplasmiques, les médicaments en « nib »
- Les molécules impliquées dans le cycle cellulaire (CDK4/6, cyclines)
- Les molécules impliquées dans l'angiogenèse et la néo-angiogenèse
- Les processus à l'origine de l'apoptose
Du fait d'une meilleure tolérance en utilisation chronique, ces médicaments peuvent être aussi des traitements de maintenance du cancer, à l'instar des pathologies cardiovasculaires, par exemple car souvent le cancer est devenu une maladie dite chronique !
Une classification en pleine évolution
Les anticorps monoclonaux pour viser une cible extra-cellulaire "mab"
Ce sont de grosses molécules produites en laboratoire. Leur mode d'action est similaire aux anticorps naturels produits par le système immunitaire.
- Ils reconnaissent et se lient spécifiquement à certaines protéines présentes à l'extérieur ou à la surface des cellules cancéreuses (récepteurs) et qui les incitent à se diviser de façon incontrôlée ou à survivre.
- Ils neutralisent ces protéines et par conséquent stoppent la croissance tumorale.
- Ils peuvent être combinés à un médicament de chimiothérapie, à une toxine ou à une substance radioactive dans le but de les délivrer spécifiquement aux cellules cancéreuses.
- Ils sont toujours administrés par voie intraveineuse.
Les petites molécules pour viser une cible intra-cellulaire "nib"
- Elles pénètrent à l'intérieur des cellules cancéreuses
- Elles neutralisent une parmi les cibles responsables de la croissance maligne
- Elles sont actives par voie orale
Les médicaments de thérapie ciblée peuvent, aussi, être classés en fonction de leur mode de fonctionnement, ou de ce qu'ils ciblent au sein des cellules.
Les inhibiteurs d'enzymes qui sont des protéines qui accélèrent les processus biologiques.
- Ils bloquent certaines enzymes responsables de la division des cellules cancéreuses.
- Les inhibiteurs de la tyrosine kinase (ITK) interfèrent avec une enzyme qui joue un rôle important dans la croissance et la division des cellules, bloquent des tyrosines kinases spécifiques qui indiquent aux cellules cancéreuses de se développer.
Selon leur cible au sein de la cellule
- Les médicaments affectant la transduction des signaux à l’intérieur des cellules, à partir d'un récepteur, habituellement membranaire
- Les molécules bloquant l’angiogenèse
- Les produits affectant la transduction et/ou la mécanique du cycle cellulaire
- Les substances stimulant l’apoptose
- Les molécules qui induisent la dégradation des protéines
Un biomarqueur c'est...
C'est un paramètre biologique qui sert à évaluer un processus physiologique ou physiopathologique, à diagnostiquer ou à prédire une maladie, la mortalité ou à mesurer ou prédire la réponse de l’organisme à une intervention thérapeutique.
Biothérapies nécessitant le dosage d'un biomarqueur
|
DOSAGE AU PRÉALABLE DU TRAITEMENT D'UN BIOMARQUEUR |
||
|
Afatinib |
Gefitinib |
Trametinib |
Les mécanismes de résistance aux thérapies ciblées
| Résistance primaire | Résistance secondaire |
|---|---|
|
|
Pour résumer...
Les thérapies ciblées sont des traitements conçus pour "cibler" spécifiquement à certaines molécules ou processus biologiques impliqués dans le développement et la croissance de certains types de cancers. Contrairement aux à la chimiothérapie qui vise toutes les cellules à multiplication rapide, les thérapies ciblées agissent de manière plus spécifique, en se agissant sur des anomalies génétiques, des protéines spécifiques, ou d'autres mécanismes moléculaires propres aux cellules tumorales.
Les principales caractéristiques des thérapies ciblées :
- La spécificité : elles visent des mutations ou des altérations spécifiques présentes dans les cellules cancéreuses, ce qui réduit les effets sur les cellules normales.
- Moins d'effets secondaires : en étant plus "ciblées", elles entraînent généralement moins d'effets indésirables graves que les traitements classiques.
Types d'actions :
- Inhiber les signaux de croissance des cellules cancéreuses.
- Bloquer les récepteurs qui aident les tumeurs à se développer.
- Stimuler la mort programmée des cellules malades (apoptose).
- Empêcher la formation de nouveaux vaisseaux sanguins qui nourrissent les tumeurs (angiogenèse).
Principe de la nomenclature
Nom = préfixe + sous-racine + racine
• tin : inhibiteur de tyrosine kinase
• zom : inhibiteur du protéasome (bortezomib, Velcade)
• cicl : inhibiteur des kinases dépendants des cyclines
• par : inhibiteur de PARP (olaparib)
• limus : activités dans les voies de signalisation m-Tor
Mise à jour
14 octobre 2024

